1、选择题 不能用磨口玻璃瓶贮存的一组物质是
A.盐酸、硫酸、Fe2(SO4)3溶液
B.NaCl、KCl、AgNO3溶液
C.NaOH溶液、水玻璃
D.MnO2、KClO3、KMnO4固体
参考答案:C
本题解析:玻璃的主要成分为SiO2,SiO2会与碱反应,使瓶塞无法打开。
本题难度:困难
2、填空题 (12分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分
| 含量/(mg?L-1)
| 成分
| 含量/(mg?L-1)
|
Cl-
| 18980
| Ca2+
| 400
|
Na+
| 10560
| HCO3-
| 142
|
SO42-
| 2560
| Br-
| 64
|
Mg2+
| 1272
| ?
| ?
|
(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
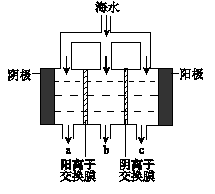
①阳极主要电极反应式是?。
②在阴极附近产生少量白色沉淀,其成分有?和CaCO3,生成CaCO3的离子方程式是?。
③淡水的出口为?(填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:

①提取溴的过程中,经过2次Br-→Br2转化的目的是?,吸收塔中发生反应的离
子方程式是?。用平衡移动原理解释通空气的目的是?。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是?、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为?L(忽略Cl2溶解)。
参考答案:(12分)
(1)①(1分)2Cl—-2e—=Cl2↑
②(1分)Mg(OH)2?(2分)Ca2++ OH—+HCO3—=CaCO3↓+H2O
③(1分)b
(2)①(1分)对溴元素进行富集?(2分)SO2+Br2+2H2O=4H++2Br—+SO42—
(1分)通入空气将Br2蒸气带出,使Br2(g) Br2(aq)或
Br2(aq)或
Br2+H2O HBr+HBrO平衡向左移动
HBr+HBrO平衡向左移动
②(1分)加热浓缩、冷却结晶
③(2分)182
本题解析:(1)在阳极放电的离子为阴离子,且阴离子的放电能力由强到弱的顺序为:S2->I->Br->CL->OH->含氧酸根离子>F-,所以该阳极的电极反应式为CL-放电。
在阴极放电的离子为阳离子,且阳离子的放电能力由强到的顺序为:Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>AL3+>Mg2+>Na+>Ca2+>K+;所以该阴极的电极反应式为H+(水)放电,破坏了水的电离平衡,使阴极附近OH-浓度增大;
(2)在滤液中通入CL2是将滤液中的Br-氧化为Br2,再利用热的空气将Br2吹出,进入吸收塔与SO2反应,其反应的离子方程式为:SO2+Br2+2H2O=4H++2Br—+SO42—;再通入CL2将Br-氧化为Br2,两次Br-→Br2转化的目的是对溴元素进行富集;
本题难度:一般
3、选择题 要使3.2 g氧化铁完全还原,事先应准备的CO在标准状况下的体积为( )。
A.1 344 mL
B.672 mL
C.大于1 344 mL
D.小于672 mL
参考答案:C
本题解析:根据Fe2O3+3CO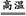 2Fe+3CO2计算出所需CO体积的理论值为1 344 mL,而实验开始时,需先通入CO排尽玻璃管中的空气,实验结束时,停止加热后,还需继续通入CO至试管冷却,以防还原出来的铁被氧化,另外,还应考虑到通入的CO不可能全部参加反应,故应大于1 344 mL。
2Fe+3CO2计算出所需CO体积的理论值为1 344 mL,而实验开始时,需先通入CO排尽玻璃管中的空气,实验结束时,停止加热后,还需继续通入CO至试管冷却,以防还原出来的铁被氧化,另外,还应考虑到通入的CO不可能全部参加反应,故应大于1 344 mL。
本题难度:一般
4、选择题 实验室保存下列药品的方法正确的是
A.少量金属钾保存在煤油中
B.少量白磷保存在CS2中
C.水玻璃保存在带玻璃塞的细口瓶中
D.液溴保存在细口瓶中,并在瓶中加少量水
E.浓硝酸保存在棕色试剂瓶中
F.KOH溶液保存在带玻璃塞的细口瓶中
参考答案:ADE
本题解析:金属K可以保存在煤油中。A正确。
白磷通常保存在水中,而不能保存在CS2中,因为白磷易溶于CS2形成溶液。B不正确。
水玻璃是Na2SiO3溶液,是一种黏合剂,能将玻璃塞与玻璃瓶黏合在一起不能打开。C不正确。
液溴通常保存在细口瓶中,保存液溴的细口瓶中加少量水(密度小,浮在上面)可以防止液溴挥发。D正确。
浓HNO3见光易分解,通常保存在棕色瓶中。E正确。
KOH溶液显碱性,能与玻璃反应:
2KOH+SiO2====K2SiO3+H2O
产生的K2SiO3同Na2SiO3一样能将瓶子与塞子黏合在一起而不能打开。F不正确。
本题难度:一般
5、选择题 下列说法正确的是( )
A.石英玻璃和普通玻璃成分相同
B.工艺师可用盐酸刻蚀玻璃制作工艺品
C.由石英沙制备单晶硅不涉及氧化还原反应
D.Si可用于信息存储,SiO2可用于光纤通讯
参考答案:D
本题解析:
本题难度:一般