1、选择题 已知氢气在氯气中燃烧时产生苍白色火焰,在反应过程中,破坏1 mol氢气的化学键消耗的能量为Q1 kJ,破坏1 mol氯气的化学键消耗的能量为Q2kJ ,形成1 mol氯化氢中的化学键消耗的能量为Q3kJ,下列关系式正确的是 (?)
A.Q1 + Q2 > Q3
B.Q1 + Q2 > 2Q3
C.Q1 + Q2 < Q3
D.Q1+ Q2 < 2Q3
参考答案:D
本题解析:1mol氢气和1mol氯气完全反应生成2molHCl为放热反应,故破坏1 mol氢气的化学键消耗的能量为Q1 kJ和破坏1 mol氯气的化学键消耗的能量为Q2kJ之和小于形成2 mol氯化氢中的化学键消耗的能量2Q3kJ;故选D。
本题难度:一般
2、选择题 热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气,并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
参考答案:C
本题解析:略
本题难度:简单
3、选择题 下列变化属于吸热反应的是
①用镁条引燃铝、氧化铁混合粉末?②碳酸钙受热分解?③浓硫酸稀释?
④氢氧化钡晶体和氯化铵固体反应?⑤生石灰和水反应
A.②④
B.①④
C.②③
D.①⑤
参考答案:A
本题解析:①③⑤放热反应,②④吸热反应,强酸强碱溶于水放热,铝热反应放出大量的热。
本题难度:一般
4、选择题 物质发生化学反应时:①电子总数 ②原子总数 ③分子总数 ④物质的种类? ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是:(?)
A.①②⑤
B.②③⑥
C.①②③
D.④⑤⑥
参考答案:A
本题解析:略
本题难度:简单
5、填空题 (15分)
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为?。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)=?。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为?? (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b?、
c?。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
?;实验a和c的平衡转化率:αa为?、αc为?。
参考答案:
⑴AX3(l)+X2(g) = AX5(s) ?ΔH=-123.8KJ·mol-1(2分)
⑵① (3 分)
(3 分)
②bca(2分) b、加人催化剂。反应速率加快,但平衡点没有改变(2分)
c、 温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)(2分)
③α=2(1- ) (2分)? 50%(1分)?40% (1分)
) (2分)? 50%(1分)?40% (1分)
本题解析:⑴据题意,先写出反应方程式并标出各物质的状态AX3(l)+X2(g) = AX5(s),然后确定其反应热ΔH=-123.8KJ·mol-1,综上便可写出完整的热化学方程式。
⑵①
解:开始时no =" 0.4" mol,总压强为160 kPa,平衡时总压强为120 kPa,
则n为: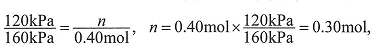
AX3(g) + X2(g)? ?AX5(g)
?AX5(g)
起始时no/mol:? 0.20? 0.20? 0
平衡时n/mol:: 0.20 -x? 0.20 -x? x
(0.20-x)+(0.20-x)+x = 0.30
x = 0.10
 ?
?
②从图中观察平衡的时间(tb<tc<ta),判断反应速率的快慢为b>c>a;
b组的反应速率加快,但平衡点没有改变说明是加人了催化剂;
c组的反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)说明是温度升高。
③用三段式分析:
AX3(g)?+? X2(g)? ?AX5(g)
?AX5(g)
起始时no/mol:? 0.20? 0.20? 0
变化量n/mol::? 0.20α? 0.20α? 0.20α
平衡时n/mol:: 0.20 -0.20α? 0.20 -0.20α? 0.20α
据题意有 ,化简得α=2(1-
,化简得α=2(1- );
);
将图中p0、p的数据代入上述计算式得αa=2(1- )=2(1-
)=2(1-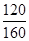 )=50%;
)=50%;
αc=2(1- )=2(1-
)=2(1-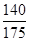 )=40%。
)=40%。
本题难度:一般