|
高中化学知识点大全《物质的量》考点强化练习(2017年押题版)(八)
2017-11-11 01:55:40
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 NA表示阿伏加德罗常数,下列说法正确的是( )
A.1mol/L Na2CO3溶液中的 Na+ 数目为2NA
B.标准状况下,11.2LSO3所含分子数为0.5NA
C.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子
D.各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
|
参考答案:C
本题解析:A、没有讲明体积,故无法计算,错误。
B、标准状态下,SO3为固体,故不能使用气体摩尔体积公式,错误。
D、铁与盐酸反应的方程式为Fe+2HCl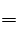 FeCl2+H2,1molFe转移2mol的电子,5.6g铁为0.1mol,故转移0.2mol电子,错误。 FeCl2+H2,1molFe转移2mol的电子,5.6g铁为0.1mol,故转移0.2mol电子,错误。
考点:物质的量
点评:此题考核了利用阿伏伽德罗常数来进行物质的量的计算,要注意所谓条件下,物质的状态是否可以使用该状态下的计算公式。
本题难度:一般
2、填空题 某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,并取出100mL该盐酸溶液与2mol/L的Ba(OH)2溶液进行中和反应。
(1)根据公式 ,可知该HCl气体的物质的量为________。
(2)根据公式 ,可知所配成的盐酸溶液的物质的量浓度为 。
(3)100mL盐酸溶液中含HCl的物质的量为 ,
(4)根据化学反应方程式 ,可知反应过程中n[Ba(OH)2]: n(HCl) = ,所以n[Ba(OH)2]为 mol,因此,反应所消耗的的体积Ba(OH)2为 。
参考答案:(1)n=V/Vm 2mol; (2)C="n/V " 4mol/L (3)0.4mol
(4) 2HCl + Ba(OH)2 = BaCl2 + 2H2O 1:2 0.2 100ml
本题解析:略
本题难度:一般
3、选择题 配制100 mL2.0 mol·L-1 NaOH溶液时,不需要用到的仪器是
[ ? ]
A.
B.
C.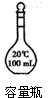
D.
参考答案:D
本题解析:
本题难度:简单
4、选择题 实验中需用2.0 mol·L-1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为? ( )。
A.950 mL;201.4 g
B.1 000 mL;212.0 g
C.100 mL;21.2 g
D.500 mL;100.7 g
参考答案:B
本题解析:实验室中没有950 mL容量瓶,故只能配制1 000 mL 2.0 mol·L-1的Na2CO3溶液。
本题难度:一般
5、简答题 Ⅰ.如图所示是分离混合物时常用的仪器,回答下列问题:
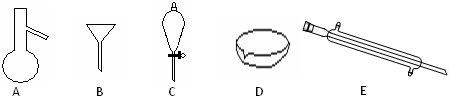
(1)写出仪器A、C、E的名称______
(2)分离以下混合物应该主要选用什么仪器?(填字母符号)
食用油和酒精:______?汽油和水:______
Ⅱ.实验室用固体烧碱配制200mL?0.5mol?L-1的NaOH溶液.
(1)需称量______?g?烧碱,应放在______中称量、溶解.
(2)完成此配制实验,除了量筒,烧杯,玻璃棒外还需要的常见的玻璃仪器有______
(3)请描述定容操作应采取的具体方法______.
参考答案:Ⅰ(1)图中A是蒸馏烧瓶、C是分液漏斗、E是冷凝管,故答案为:蒸馏烧瓶、分液漏斗、冷凝管;
(2)食用油和酒精,互溶,沸点相差较大,可以采取分馏的方法分离,需要用到的仪器为蒸馏烧瓶、冷凝管等,汽油和水为互不相溶的液体,可以利用分液方法分离,需要的仪器为分液漏斗,
故答案为:AE;C;
Ⅱ(1)没有200mL容量瓶,应选择250mL容量瓶,故需要氢氧化钠的质量为0.25L×0.5mol?L-1×40g/mol=5.0g,
氢氧化钠具有腐蚀性、易潮解,应放在烧杯内,迅速称量、溶解,
故答案为:5.0;烧杯;
(2)配制氢氧化钠溶液需要玻璃仪器有烧杯、玻璃棒、250mL容量瓶、胶头滴管等,
故答案为:250mL容量瓶、胶头滴管;
(3)定容操作为:向容量瓶内注入蒸馏水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线正好水平相切,
故答案为:向容量瓶内注入蒸馏水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线正好水平相切.
本题解析:
本题难度:一般
|