1、选择题 在密闭容器中的一定量混合气体发生反应: 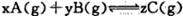 平衡时测得A的浓度为0. 5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时A的浓度变为0. 3m ol/L。下列有关判断正确的是
平衡时测得A的浓度为0. 5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时A的浓度变为0. 3m ol/L。下列有关判断正确的是
A.B的转化率降低
B.x+y<z
C.平衡向正反应方向移动
D.C的体积分数增大
参考答案:A
本题解析:本题考查化学平衡移动,利用假设法判断平衡移动方向是解题关键。根据题意知,保持温度不变,将容器的体积扩大到原来的两倍,假设平衡不移动,A的浓度为0.25mol/L,实际A的浓度变为0.3mol/L,说明平衡向生成A的方向移动,即向逆反应移动;A、平衡向逆反应移动,B的转化率降低,正确;B、平衡向逆反应移动,减小压强平衡向气体物质的量增大的方向移动,即x+y>z,错误;C、由上述分析可知,平衡向逆反应移动,错误;D、平衡向逆反应移动,C物质的量减小,故C的体积分数下降,错误。
本题难度:一般
2、填空题 (1)在实验室中作小型实验:把物质A、B按一定比例充入一个表面积为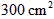 的圆柱形容器,使压强为P,然后将整个体系用加热器加热到280℃,发生如下反应
的圆柱形容器,使压强为P,然后将整个体系用加热器加热到280℃,发生如下反应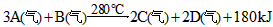 ,若平均每分钟生成0.5 mol的C,容器表面向外散热速率平均为
,若平均每分钟生成0.5 mol的C,容器表面向外散热速率平均为 ,为了维持恒温280℃,平均每分钟需用加热器向容器提供多少kJ的热量.(简述推理过程)
,为了维持恒温280℃,平均每分钟需用加热器向容器提供多少kJ的热量.(简述推理过程)
答:_________________________________________.
(2)若将(1)的小型实验扩大为工业生产:将反应容器的底面半径和高度都扩大到原容器的10倍,做成“相似体”,并向其中将A、B按原比例充入,使压强仍为P,然后加热到280℃使反应开始。为了维持恒温280℃,反应开始后,应继续加热还是进行冷却?(设容器表面散热速率不变)
平均每分钟用加热器向体系提供或者用冷却器吸收了多少kJ的热量.(简述推理过程)
答:________________________________________.
(3)在恒温、恒压下,向(2)的“相似体”平衡体系中将A、B按原比例充入,重新达到平衡时,C的体积分数_________。
参考答案:(1)按1分钟计,生成0.5mol C产生热量45kJ,而容器散热
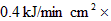
 ,所以应用加热器每分钟提供热量120kJ-45kJ=75 kJ
,所以应用加热器每分钟提供热量120kJ-45kJ=75 kJ
(2)容器半径和高度都变为原来10倍,则表面变为原来1000倍,平均每分钟生成C为
0.5 mol×1000=500 mol,放出热量45000kJ,而容器散热12000kJ,所以冷却器每分钟吸收热量
45000kJ-12000kJ=33000kJ
(3)不变
本题解析:
本题难度:一般
3、填空题 (12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) 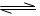 CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
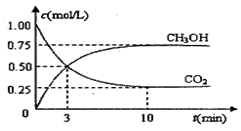
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=?mol/(L·min)
(2)该反应的平衡常数为?。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是?。
A.升高温度?B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离?D.再充入lmol CO2和3mol H2
(4)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H= —1275.6kJ/mol
②H2O(g)=H2O(1)?△H= —44.0kJ/mol
则甲醇的燃烧热化学方程式为:?;
(5)如果燃烧甲醇会造成大量化学能损失,如果以甲醇和空气为原料,以氢氧化钠为电解质溶液设计成原电池将有很多优点,请书写出该电池的负极反应:___________________
(6)常温下,某水溶液M中存在的离子有:Na+、A—、H+、OH—。若该溶液M由 pH=3的HA溶液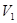 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液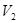 mL混合反应而得,则下列说法中正确的是? __。
mL混合反应而得,则下列说法中正确的是? __。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
参考答案:(1)0.225 (2分)?(2)16/3(5.33) (2分)?(3)CD(2分)?
(4)CH3OH(l)+ 3/2 O2 (g) = CO2(g) + 2H2O(L)?△H= -725.8KJ/mol(2分)
(5) CH3OH +8 OH- -6e- = CO32- + 6H2O(2分)(6)AD (2分)
本题解析:
⑴v(H2)="3" v(CO2)=(1.0―0.25)mol/L×3/10min=0.225mol/(L·min)
⑵?CO2(g)+3H2(g) 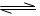 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
C始? 1? 3
C变? 0.75? 2.25? 0.75? 0.75
C平? 0.25? 0.75? 0.75? 0.75
⑶C? D
A、升高温度,平衡逆向移动,n(CH3OH)/n(CO2)减小;B、平衡不移动,n(CH3OH)/n(CO2)不变。
⑷(①+4②)/2得:CH3OH(l)+ 3/2 O2 (g) = CO2(g) + 2H2O(L)?△H= -725.8KJ/mol
(5) CH3OH +8 OH- -6e- = CO32- + 6H2O
(6)AD
本题难度:一般
4、选择题 将反应Cu (s) + 2Ag+ (aq)  ?Cu2+ (aq) + 2Ag (s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是
?Cu2+ (aq) + 2Ag (s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是
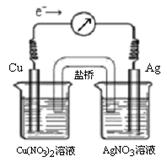
A.KNO3盐桥中的K+移向Cu(NO3)2溶液
B.当电流计指针为0时,该反应达平衡,平衡常数K=0
C.若此时向AgNO3溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转
D.若此时向Cu(NO3)2溶液中加入NaOH固体,随着NaOH量的增加电流计指针向右偏转幅度减小→指针指向0→向左偏转
参考答案:C
本题解析:A、根据电子流向,Cu为负极,而KNO3盐桥中的K+移向正极,错误;B、该反应达平衡时各物质的量不在变化,也不会有能量的变化,所以电流计指针为0,但平衡常数不为0,错误;C、随着NaCl量的增加,Ag+的浓度下降,反应速率减小(电流计指针向右偏转幅度减小)直到建立平衡(指针指向0),Ag+的浓度再下降,会使平衡逆移(向左偏转),正确;D、NaOH量的增加,正反应速率不变,电流计指针向右偏转幅度不变,错误。
本题难度:一般
5、选择题 已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)  CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是(?)
CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是(?)
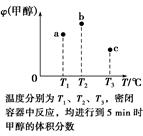
A.正反应的ΔH>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可将b中的平衡状态转变成c中的平衡状态
D.达到平衡时,a、b、c中CO的转化率为b>a>c
参考答案:C
本题解析:本题的关键点是温度不同,选取的时间是5 min,a肯定没有达到平衡,b可能达到平衡也可能没有,c肯定达到平衡。若三者均达到平衡,则甲醇的含量应依次降低,正反应是放热反应,A、B、D错误。
本题难度:一般