1、选择题 在一定体积的容器中加入1.5mol氙气(Xe)和7.5mol氟气,于400℃和2633kPa压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气,则所得无色晶体产物中,氙与氟的原子个数之比是(?)?
A.1∶2
B.1∶3
C.1∶4
D.1∶6
参考答案:C
本题解析:根据题意知,7.5moL氟气反应剩余4.5mol氟气,反应了3mol氟气,即1.5molXe与3moL氟气反应,根据质量守恒定律知,生成物中氙原子与氟原子物质的量之比为1.5:3×2=1:4,选C。
本题难度:一般
2、选择题 下列单位中,不属于国际单位制中七种基本计量单位之一的是( )
A.米
B.千克
C.摩尔
D.厘米
参考答案:D
本题解析:厘米不是基本单位。
本题难度:简单
3、选择题 下列反应中,不属于化合、分解、置换、复分解等四种基本反应类型的是
A.CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
B.2FeCl3+Cu=2FeCl2+CuCl2
C.Cu2(OH)2CO3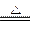 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
参考答案:B
本题解析:略
本题难度:简单
4、选择题 正确掌握化学用语是学好化学的基础,下列有关表述正确的是
A.H、D、T互为同素异形体
B.氨分子中的化学键为非极性共价键(? )?
C.NH4Cl的电子式:
D.S2-的结构示意图: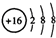
参考答案:D
本题解析:A选项同素异形体是对于单质来说的。所以A是错误的。B选项非极性键主要存在于相同的非金属元素之间,所以B选项是错误的。C选项氯没有标出电子所以C选项是错误的
本题难度:简单
5、选择题 将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量可能为9.6g
B.沉淀完全时消耗NaOH溶液体积为150mL
C.参加反应的硝酸的物质的量为0.4mol
D.溶解合金时产生NO气体体积0.224L