1、填空题 (6分)将2.4mol某金属投入1.8L 2mol/L的盐中,恰好完全反应,并得到7.2gH2,则某金属的化合价为?,酸为?元酸。
参考答案:+3,2
本题解析:略
本题难度:一般
2、简答题 标准状态下,将11.2LHCl气体溶于水,制成250ml溶液
(1)试求该盐酸溶液的物质的量浓度
(2)如果用质量分数为36.5%密度为1.2g/cm3?的浓盐酸来配制上述溶液,则应量取该浓盐酸多少毫升进行稀释.
参考答案:(1)标准状态下,n(HCl)=11.2L22.4L/mol=0.5mol,
c(HCl)=0.5mol0.25L=2mol/L,
答:该盐酸溶液的物质的量浓度为2mol/L;
(2)设需要该浓盐酸的体积为Vml,溶液稀释前后溶质的物质的量不变,则
Vml×1.2g/ml×36.5%36.5g/mol=0.5mol,
解之得:V=41.7,
答:应量取该浓盐酸41.7ml进行稀释.
本题解析:
本题难度:一般
3、填空题 (本题7个空,每空2分,共14分)
(1)9.5g MgCl2溶于水配成100mL溶液,所得溶液的物质的量浓度为 ,取溶液25.0mL,稀释到500mL,此时溶液中Cl-的物质的量浓度为 ,在这两个实验中除了用烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是 。
(2)在反应3Cl2 + 6KOH(浓) ="=" 5KCl + KClO3 + 3H2O中,氧化产物与还原产物的物质的量之比为 ,3molCl2参加该反应时,反应中转移 mol电子。
(3)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3- +4H++3e- = NO↑+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
①写出该氧化还原反应的化学方程式(不需要配平): 。
②反应中硝酸体现了 的性质。
参考答案:(1)1mol·L-1,0.1mol·L-1,玻璃棒、100mL容量瓶。
(2)1:5,5。
(3)①Cu2O+HNO3(稀)——Cu(NO3)2+NO↑+H2O。
②氧化性和酸性。
本题解析:(1)9.5g MgCl2的物质的量n=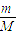 =
= =0.1mol,配成100mL溶液根据公式C=
=0.1mol,配成100mL溶液根据公式C= =
= =1mol/L;取配得的Mg Cl2溶液25.0mL,稀释到500mL,也就是将原溶液稀释20倍,所以,此时MgCl2的浓度为
=1mol/L;取配得的Mg Cl2溶液25.0mL,稀释到500mL,也就是将原溶液稀释20倍,所以,此时MgCl2的浓度为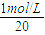 =0.05mol/L,所得Mg Cl2溶液中Cl-的物质的量浓度为MgCl2浓度的两倍为0.1mol/L。还需用到的玻璃仪器是玻璃棒、100mL容量瓶。(2) 该反应中Cl2既是氧化剂又是还原剂。化合价升高为的氯原子对应的产物KCO3是氧化产物,化合价降为的氯原子生成的产物KCl是还原产物,其物质的量之比为1:5。3molCl2参加该反应时,生成1mol KClO3,Cl元素化合价升高5价,则转移电子5mol。(3)①硝酸具有氧化性,题目提供的四种物质中只有Cu2O具有还原性,所以反应的方程式为硝酸与Cu2O反应生成硝酸铜、NO与水,反应方程式为:14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O,②反应中硝酸中氮元素存在硝酸铜、NO中,硝酸铜中氮元素化合价不变,硝酸表现酸性,NO中氮元素化合价降低,硝酸表现氧化性。
=0.05mol/L,所得Mg Cl2溶液中Cl-的物质的量浓度为MgCl2浓度的两倍为0.1mol/L。还需用到的玻璃仪器是玻璃棒、100mL容量瓶。(2) 该反应中Cl2既是氧化剂又是还原剂。化合价升高为的氯原子对应的产物KCO3是氧化产物,化合价降为的氯原子生成的产物KCl是还原产物,其物质的量之比为1:5。3molCl2参加该反应时,生成1mol KClO3,Cl元素化合价升高5价,则转移电子5mol。(3)①硝酸具有氧化性,题目提供的四种物质中只有Cu2O具有还原性,所以反应的方程式为硝酸与Cu2O反应生成硝酸铜、NO与水,反应方程式为:14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O,②反应中硝酸中氮元素存在硝酸铜、NO中,硝酸铜中氮元素化合价不变,硝酸表现酸性,NO中氮元素化合价降低,硝酸表现氧化性。
考点:考查配制一定物质的量浓度的溶液,氧化还原反应。
本题难度:一般
4、填空题 用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol?L-1稀硫酸,若实验仪器有:
A.100mL量筒B.托盘天平C.玻璃棒D.50mL容量瓶
E.10mL量筒?F.50mL烧杯?G.100mL容量瓶
(1)完成该实验还缺少的仪器是______.
(2)本实验需量取浓硫酸的体积为______mL,量取时应选择的仪器是(填上述序号)______.
(3)在容量瓶使用方法中,下列操作不正确的是(填序号)______.
A.使用容量瓶前检查它是否漏水
B.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
C.将准确量取的18.4mol?L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
①所用的浓硫酸长时间放置在密封不好的容器中______
②.容量瓶用蒸馏洗涤后残留有少量的水______
③.定容时俯视溶液的液凹面______.
参考答案:(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、100mL容量瓶,故答案为:胶头滴管;
(2)设需要98%H2SO4的体积为VmL,根据溶液稀释前后溶质质量不变则,VmL×1.84g/cm3×98%=100mL×1mol?L-1×98g/mol,解得V=5.4ml,选用量筒的规格为10mL,故答案为:5.4;E;
(3)A.使用容量瓶前检查它是否漏水,以防止摇匀时液体漏出,产生误差,故A错误;
B.因氢氧化钠固体具有吸湿性,很容易潮解,所以放在玻璃器皿中称量,氢氧化钠溶于水时放热,须等溶液冷却后转移到容量瓶,故B正确;
C.容量瓶不能溶解固体或稀释浓溶液,故C正确;
D.定容后,为了使溶液混合均匀,应塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀,故D错误;
故选:BC;
(4)①所用的浓硫酸长时间放置在密封不好的容器中,量取的浓硫酸的质量减少,浓度减少,故答案为:偏小;
②容量瓶用蒸馏洗涤后残留有少量的水,溶液的体积不变,浓度不变,故答案为:无影响;
③定容时俯视溶液的液凹面,体积偏小,浓度偏大,故答案为:偏大.
本题解析:
本题难度:简单
5、选择题 将一定体积的稀硝酸平均分成两份,在其中一份中加入足量铜粉,生成的气体在标准状况下的体积为V1;在另一份中先加入与其体积相等的稀硫酸,再加入足量铜粉同,生成的气体在标准状况下的体积为V2,已知V2=3V1。则稀硝酸和稀硫酸的物质的量浓度之比为?(?)
A.1:1
B.1:2
C.1:3
D.1:4
参考答案:B
本题解析:略
本题难度:一般