1、选择题 在下列粒子半径的比较中,正确的是
A.Na+>Na
B.Cl->Cl
C.Ca2+>Cl-
D.Mg>Na
参考答案:B
本题解析:阳离子的半径比其原子半径小,阴离子半径比其原子半径大,所以A错B对;Ca2+和Cl-均具有和Ar原子相同的电子层结构,因Ca2+的核电荷数大,故半径Ca2+<Cl-,C错误;Mg和Na的原子核外电子层数相同,Mg的核电荷数大于Na,则Mg的原子半径小于Na,D错误。
本题难度:一般
2、选择题 下列说法都正确的是
[? ]
①江河入海口三角洲的形成通常与胶体的性质有关
②四川灾区重建使用了大量钢材,钢材是合金
③“钡餐”中使用的硫酸钡是弱电解质
④太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
⑤常用的自来水消毒剂有氯气和二氧化氮,两者都含有极性键
⑥水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物
A.①②③④
B.①②④⑥
C.①②⑤⑥
D.③④⑤⑥
参考答案:B
本题解析:
本题难度:简单
3、推断题 六种短周期元素aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三种元素形成的六原子核的化合物和水反应的离子方程式是___________________
(2)A、C形成的四原子核化合物甲的电子式为______________,该化合物呈弱酸陛,试写出这种化合物的电离方程式___________________
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式____________
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液反应的化学方程式________________
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式_____________
(6)A、E形成的四原子核化合物丙容易液化,其原因是_____________
参考答案:(1)SO32-+H2O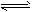 HSO3-+OH-(HSO3-+H2O
HSO3-+OH-(HSO3-+H2O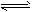 H2SO3+OH-)
H2SO3+OH-)
(2)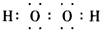 ;H2O2
;H2O2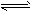 HO2-+H+ (HO2-
HO2-+H+ (HO2-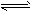 O22-+H+)
O22-+H+)
(3)H++HSO3-=SO2↑+H2O
(4)H2O2+H2SO3=H2SO4+H2O
(5)Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓
(6)分子间形成氢键,增加了分子之间的作用力,使之易液化
本题解析:
本题难度:一般
4、简答题 四种短周期元素的微粒信息如下表:
| 元素代号 | Q | R | X | Z
微粒信息
离子: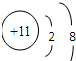
单质分子:R2
离子:X3+
一种原子:Z
|
已知Q、R、X在同一周期,R2常温常压下为气体
完成下列填空:
(1)Q位于周期表第______周期第______族.化合物Q2Z的电子式为______(用元素符号表示).
(2)Q、R、X的原子半径由大到小的顺序为______(用元素符号表示);Q、R、X、Z中金属性最强的是______(用元素符号表示).
(3)Q与X两者的最高价氧化物对应的水化物之间发生反应的离子方程式为:______.
参考答案:由四种短周期元素的微粒信息可知,Q的质子数为11,为Na;Z的质子数为8,则Z为O;Q、R、X在同一周期,且X为+3价,则X为Al;R2常温常压下为气体,R为Cl,
(1)Q位于第三周期第ⅠA族,化合物Q2Z的电子式为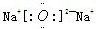 ,故答案为:三;ⅠA;
,故答案为:三;ⅠA;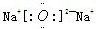 ;
;
(2)Q、R、X位于同周期,原子序数大的半径小,则原子半径由大到小的顺序为Na>Al>Cl,四种元素中只有Na、Al为金属,Na的金属性强,
故答案为:Na>Al>Cl;Na;
(3)Q与X两者的最高价氧化物对应的水化物之间发生反应的离子方程式为OH-+Al(OH)3=[Al(OH)4]-,故答案为:OH-+Al(OH)3=[Al(OH)4]-.
本题解析:
本题难度:一般
5、选择题 下列离子中,所带电荷数与该离子的核外电子层数相等的是:
A.Mg2+
B.Al3+
C.Be2+
D.H+
参考答案:A
本题解析:试题分析:A项Mg2+核外有2个电子层,正确;B项:Al3+核外有2个电子层,错误;C项:Be2+ 核外有1层,错误 D项:H+核外没有电子层,错误。
考点:原子核外电子的排布规律。
本题难度:简单