1、选择题 已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示。下列说法正确的是
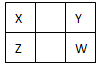
A.Z元素的原子半径可能比Y元素的小
B.Z的最高价氧化物的水化物的酸性一定比W的强
C.W的气态氢化物的稳定性一定比Y的强
D.Z元素的最高化合价可能比Y元素的高
参考答案:D
本题解析:略
本题难度:一般
2、选择题 下列有关元素锗及其化合物的叙述中正确的是
A.锗的第一电离能高于碳而电负性低于碳
B.四氯化锗与四氯化碳分子都是四面体构型
C.二氧化锗与二氧化碳都是非极性的气体化合物
D.锗和碳都存在具有原子晶体结构的单质
参考答案::BD
本题解析::碳和锗同主族,碳在第二周期,而锗在第四周期,锗是金属元素,故其第一电离能低于碳,A错;四氯化锗和四氯化碳都是分子晶体且构型相同,B对;金属的氧化物不是气体,C错;锗和碳都易于形成四个键,能形成原子晶体结构的单质,D对。
【考点定位】此题考查了同主族元素性质的递变规律的应用知识。
本题难度:一般
3、选择题 下列除去杂质的实验方法不正确的是
A.除去食盐中少量的I2:将固体灼烧至质量不再改变
B.除去Fe2O3中少量的Al2O3:加入足量盐酸充分反应后,过滤、洗涤、干燥
C.除去Cl2中少量的HCl气体:先通入足量饱和食盐水,然后用浓H2SO4干燥
D.除去Na2CO3固体中少量的NaHCO3:将固体灼烧至质量不再改变
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列排列顺序中错误的是(?)
A.原子半径:O<S<Na
B.稳定性:PH3>H2S>NH3
C.酸性:H3PO4<H2SO4<HClO4
D.碱性:Al(OH)3<Mg(OH)2<NaOH
参考答案:B
本题解析:O与S同族,S比O的电子层多,故半径S>O,S与Na同周期,但Na的核电荷数小,故半径Na>S,所以其顺序为O<S<Na,A正确;元素P、S同周期,非金属性P<S,稳定性PH3<H2S,所以B错;同周期元素从左到右金属性减弱非金属性增强,最高价氧化物的水化物的酸性增强碱性减弱,故C、D均正确,所以错误的为B。
本题难度:简单
5、选择题 下列关于元素周期表和元素性质的叙述正确的是
A.质子数相同的微粒之间一定互称同位素
B.I A族与ⅦA族元素间形成的化合物一定是离子化合物
C.同主族元素的简单阴离子半径越大,其单质氧化性越弱
D.同周期金属元素的化合价越高,其氢氧化物的碱性越强
参考答案:C
本题解析:A、微粒包括分子、原子、离子等,如H2O、NH3分子质子数相同,但不是同位素,错误;B、I A族与ⅦA族元素间形成的化合物也有可能为共价化合物,如HF、HCl、HBr等,错误;C、同主族元素的简单阴离子半径越大,说明元素的原子序数越大,其单质氧化性越弱,正确;D、同周期金属元素的化合价越高,其氢氧化物的碱性越弱,错误。
本题难度:一般