1、选择题 相对分子质量为M的气态化合物VL(标准状况)溶于mg水中,得到溶液的质量分数为ω%,物质的量浓度为cmol/L,密度为ρg?cm-3,则下列说法正确的是( )
A.相对分子质量M可表示为:
B.物质的量浓度C可表示为:
C.溶液的质量分数ω%可表示为:
D.溶液密度ρ可表示为:
参考答案:A、mg:m(溶质)=(1-ω%):ω%,所以m(溶质)=mω%1-ω%g,所以VL22.4L/mol×Mg/mol=mω%1-ω%g,
解得M=22.4m×ω%(1-ω%)V,所以该气体的相对分子质量为22.4m×ω%(1-ω%)V,故A正确;
B、溶质的物质的量为以VL22.4L/mol=V22.4mol,溶液质量为mg+VL22.4L/mol×Mg/mol=(m+VM22.4)g,所以溶液的体积为(m+VM22.4)gρg/ml,所以溶液浓度为V22.4molm+VM22.4ρ×10-3L=1000ρV22.4m+VMmol/L,故B错误;
C、溶质的质量为VL22.4L/mol×Mg/mol=VM22.4g,溶液质量为mg+VL22.4L/mol×Mg/mol=(m+VM22.4)g,所以质量分数为VM22.4g(m+VM22.4)g=VM22.4m+VM,故C错误;
D、由于c=1000ρω%M,所以ρ=cM1000ω%,故D正确.
故选:AD.
本题解析:
本题难度:一般
2、选择题 两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42—,若将2.83 g X中的Cr3+全部氧化为Cr2O72—后,溶液中的Cr2O72—可和过量KI溶液反应,得到3.84 g I2。反应的离子方程式为Cr2O72—+6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀,由此可推断出X的化学式为( )
A.K2SO4·Cr2(SO4)3
B.2K2SO4·Cr2(SO4)3
C.K2SO4·2Cr2(SO4)3
D.K2SO4·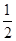 Cr2(SO4)3
Cr2(SO4)3
参考答案:A
本题解析:由Cr2O72—和足量KI溶液反应得到3.81 g(即0.015 mol) I2可知反应的Cr2O72—的物质的量为0.005 mol,则2.83 g X中含有Cr3+的物质的量为0.01 mol;由X与BaCl2的反应可知2.83 g X中含有SO42—的物质的量为0.02 mol;根据电荷守恒可知K+的物质的量为0.01 mol,可知X的化学式为K2SO4·Cr2(SO4)3,A项正确
本题难度:一般
3、选择题 关于4 ℃时在100 mL水中溶解了22.4 L HCl气体(标准状况下测得)形成的溶液,下列说法中正确的是
A.该溶液物质的量浓度为10 mol· L-1
B.该溶液物质的量浓度因溶液的密度未知而无法求解
C.该溶液中溶质的质量分数因溶液的密度未知而无法求得
D.所得溶液的体积为22.5 L
参考答案:B
本题解析:考查物质的量浓度溶液的有关计算。氯化氢的物质的量是1.0mol,溶剂是100ml,但由于不能确定溶液的密度,因此无法确定溶液的体积,所以不能计算溶液的浓度,答案选B。
本题难度:简单
4、选择题 设NA为阿伏加德罗常数的数值.下列说法不正确的是
A.常温常压下,18g14CH4所含中子数目为8NA
B.常温常压下,分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
C.含0.3molCl-的FeCl3水解制成胶体,所得胶体粒子数为0.1NA
D.60gSiO2晶体中含有硅氧键的数目为4NA