1、选择题 一定温度下,在一定容的密闭容器中充入N2和H2发生如下反应:N2+3H2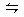 2NH3,并达到平衡,此时N2的转化率为a%,缩小容器的体积,则N2的转化率将(?)
2NH3,并达到平衡,此时N2的转化率为a%,缩小容器的体积,则N2的转化率将(?)
A.增大
B.减小
C.不变
D.无法确定
参考答案:A
本题解析:达到平衡后,缩小容器的体积,容器内压强增大,对于反应N2+3H2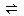 2NH3,平衡向正反应方向移动,则N2的转化率将增大。
2NH3,平衡向正反应方向移动,则N2的转化率将增大。
本题难度:一般
2、选择题 一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应: 2X (g)+Y (g)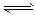 Z(g),经30s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g),经30s达到平衡,生成0.3mol Z。下列说法正确的是
[? ]
A.以X浓度变化表示的反应速率为0.02mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数减小,则该反应的△H>0
参考答案:D
本题解析:
本题难度:一般
3、选择题 在恒容的密闭容器中充入2molA和1molB的气体后发生反应2A(g)+B(g) xC(g),达到平衡后,C的体积分数为m%。若维持容器容积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质的量,达到平衡后,C的体积分数仍为m%。则x的值可能为
xC(g),达到平衡后,C的体积分数为m%。若维持容器容积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质的量,达到平衡后,C的体积分数仍为m%。则x的值可能为
A、1 B、2 C、3 D、4
参考答案:BC
本题解析:略
本题难度:一般
4、选择题 可逆反应:3A(g)?3B(?)+C(?)(△H>0),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
A.B和C可能都是固体
B.B和C一定都是气体
C.若C为固体,则B一定是气体
D.B和C可能都是气体
参考答案:3A(g)?3B(?)+C(?)(△H>0),该正反应吸热,温度升高,平衡右移,.M变小,依据反应的系数关系,气体平衡体系的质量守恒,平均摩尔质量的变化,由反应前后气体物质的量变化、混合气体的质量变化决定;
A、B和C肯定不会都是固体,若都是固体,气体物质的量减小,质量减小,.M不变,故A错误;
B、若都是气体,反应前后气体物质的量一定增大,质量不变,.M减小,但若B为气体,C为固体,反应前后气体物质的量不变,气体质量减小,.M减小,故B错误;
C、C为固体,B一定为气体,反应前后气体物质的量不变,气体质量减小,.M减小,故C正确;
D、B和C可能都是气体时,质量守恒,气体物质的量增大,.M减小,故D正确;
故选CD;
本题解析:
本题难度:一般
5、选择题 一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)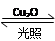 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
时间/min
| 20
| 40
| 60
| 80
|
n(O2)/mol
| 0.001 0
| 0.001 6
| 0.002 0
| 0.002 0
|
?
下列说法不正确的是? ( )。
A.前20 min内的平均反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
参考答案:C
本题解析:由题意知,v(H2O)=2v(O2)= =5.0×10-5 mol·L-1
=5.0×10-5 mol·L-1
·min-1,A正确。热化学方程式表示的含义是2 mol H2O(g)完全分解生成2 mol H2(g)和1 mol O2(g),吸收484 kJ的能量,所以生成O2 0.002 0 mol时,吸收的能量为0.002 0 mol×484 kJ·mol-1=0.968 kJ,正确。C项,由于反应物只有1种,增大c(H2O),相当于压强增大,平衡向气体体积减小的方向移动,所以水的分解率降低,错误。D项,若Cu2O颗粒小,则接触面积大,反应速率快,催化效果好,正确。
本题难度:一般