1、选择题 6.A、B、C为三种的气体,把a mol A和b mol B充入一密闭容器中,发生反应A+2B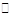 2C,达到平衡时,若它们的物质的量满足n(A)+ n(B)= n(C),则A的转化率为
2C,达到平衡时,若它们的物质的量满足n(A)+ n(B)= n(C),则A的转化率为
A. B.
B.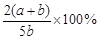
C.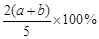 D.
D.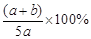
2、填空题 某温度下,将2mol A和2.8 mol B充入体积为2 L的恒容密闭容器中,发生如下反应:
aA(g)+B(g) 2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
(1) 5 min内用B表示该反应的化学反应速率为?。
(2)该温度下,此可逆反应的逆反应的平衡常数为?。
(3)a的值为?。
(4)下列说法一定能说明上述反应已达到平衡状态的是?。
①单位时间里每生成1molB的同时消耗了2mol的C?②D的物质的量不再变化
③混合气体的密度不再变化?④混合气体的平均相对分子质量不再变化
⑤体系的压强不再变化
(5)该温度下,某同学设计了以下实验,请在空格中填入热量(含Q的表达式表示)
起始
n(A)/mol
| 起始
n(B)/mol
| 起始
n(C)/mol
| 起始
n(D)/mol
| 达到平衡时放出(或吸收)的热量
|
0
| 1.6
| 8
| 足量
| ?
|
?
3、填空题 (11分)研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料:
已知:H2(g)+1/2O2(g)=H2O(g) 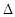 H= ?241.8kJ/mol
H= ?241.8kJ/mol
C(s)+1/2O2(g)=CO(g) 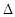 H= ?110.5kJ/mol
H= ?110.5kJ/mol
写出焦炭与水蒸气反应制H2和CO的热化学方程式 。
(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g)  2SO3(g);
2SO3(g);
△H=?a kJ/mo1,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mo1 SO2和2mol O2 B.4mol SO2、2mo1 O2和2mol SO3
C.4mol SO2和4mo1 O2 D.6mo1 SO2和4mo1 O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g) 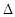 H>0
H>0
在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
A.压强不变 B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D. N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) 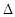 H>0,
H>0,
简述该设想能否实现的依据 。
(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)  CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为 。
CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为 。
4、选择题 某研究小组研究了其他条件不变时,改变条件对以下可逆反应的影响:
2SO2(g)+O2(g) 2SO3(g)? +Q
2SO3(g)? +Q
下列说法正确的是
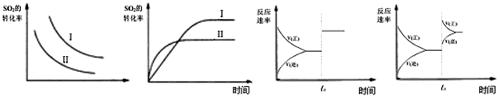
图一?图二?图三?图四
A.图一研究的是温度、压强对平衡的影响,横坐标表示压强
B.图二研究的是温度对平衡的影响,Ⅱ采用的温度更高
C.图三中t0时使用了催化剂,使平衡向正反应方向进行
D.图四中t0时增大压强,使平衡向正反应方向进行
5、选择题 在密闭容器中,一定条件下进行如下反应:
NO(g) + CO(g) 
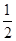 N2(g) + CO2(g);△H=-373.2 kJ/mol ,达到平衡后,为提高该反应的速率和NO的转化率,采取的措施正确的是
N2(g) + CO2(g);△H=-373.2 kJ/mol ,达到平衡后,为提高该反应的速率和NO的转化率,采取的措施正确的是
A.加催化剂
B.减小反应容器体积
C.升高温度
D.增大NO浓度