|
高中化学知识点大全《化学平衡》试题特训(2017年最新版)(二)
2017-11-11 02:12:19
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
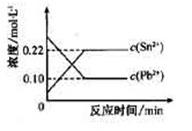
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变大
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2
|
参考答案:BD
本题解析:固体反应物,不能使平衡移动,故A错误;Sn2+浓度增大,平衡逆向移动,c(Pb2+)增大,故B正确;升高温度,平衡体系中c(Pb2+)增大,说明平衡逆向移动,该反应放热,故C错误;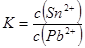 ,故D正确。 ,故D正确。
考点:本题考查化学平衡。
本题难度:一般
2、计算题 (10分计入总分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如下图的反应,各物质量起始加入量如下:M为2.5moL,N为3mol,P为0 mol。A、C、D各为0.5mol, B为Xmol,当X在一定范围内变化时,均可以调节反应器的温度,使两侧面反应达平衡,并且隔板刚处于中间位置。
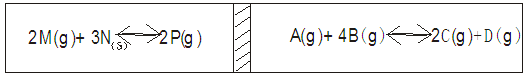
若达平衡后,测得M的转化率为75%,请读写下列空白。
①达平衡后,反应左室气体总的物质的量为 。
②若欲使右室V正>V逆,X的取值范围是 。
③若欲使右室反应V逆>V正,X的取值范围是 。
参考答案:2.5mol 1<x<2 0.5<x<1
本题解析:(1)左侧反应是体积不变的可逆反应,所以气体的总的物质的量还是2.5mol。
(2)由于隔板刚处于中间位置,所以两侧容器中气体的物质的量应该是相同的,即右侧也应该是2.5mol。由于右侧反应是体积减小的可逆反应,所以若欲使右室V正>V逆,则0.5mol+0.5mol+0.5mol+x>2.5mol,解得x>1.0mol。又因为当A完全转化时,生成C和D分别是1mol和0.5mol,消耗B是2mol。所以必须满足x-2mol+1mol+0.5mol+0.5mol+0.5mol<2.5mol,解得x<2mol,因此x的取值范围是1<x<2。
(3)若欲使右室反应V逆>V正,则应满足0.5mol+0.5mol+0.5mol+x<2.5mol,解得x<1.0mol。同样分析,当C完全转化时,生成A和B分别是0.25mol和1mol,消耗D是0.25mol。所以必须满足x+1mol+0.5mol+0.25mol+0.5mol-0.25mol>2.5mol,解得x>0.5mol,所以x的取值范围是0.5<x<1。
本题难度:困难
3、填空题 可逆反应A(?)+aB(g)  C(g)+D(g),其中a为正整数。反应过程中,当其他条件不 C(g)+D(g),其中a为正整数。反应过程中,当其他条件不
变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。试回答下列问题:
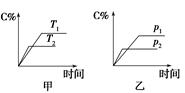
(1)化学方程式中a=?,反应物A的状态是?。
(2)该反应的焓变值ΔH?(填“>”或“<”)0,在不改变其他条件的情况下增加B的物质的量,平衡?(填“正”或“逆”)向移动,平衡常数K?(填“增大”、“减小”或“不变”)。
参考答案:(1)1 非气态
(2)< 正 不变
本题解析:(1)由乙图可以确定p2>p1,加压时C%减小,平衡逆向移动,故气体反应物的计量数之和小于气体产物的计量数之和,若A为气体,1+a≥1+1,故A为非气体,且a=1。
(2)由甲图可以确定T1<T2,温度升高,C%减小,说明正反应是放热反应,ΔH<0;在不改变其他条件的情况下增加B的物质的量,平衡正向移动,没有改变温度,平衡常数K不变。
本题难度:一般
4、实验题 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
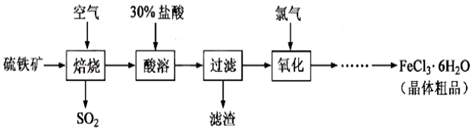
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
参考答案:(1) SO2+NaOH=NaHSO3; SO2+NaOH=NaHSO3;
(2)提高铁元素的浸出率 抑制Fe3+水解
(3)Cl2+2Fe2+=2Cl-+2Fe3+ Cl2 HCl
本题解析:(1)根据化学平衡常数概念写出平衡常数表达式;在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g) ,该反应的平衡常数表达式为 2SO3(g) ,该反应的平衡常数表达式为 ;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,化学方程式为SO2+NaOH=NaHSO3;(2)根据题给流程知,酸溶的目的是将氧化铁转化为氯化铁,盐酸可抑制铁离子水解,酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解。(3)通氯气氧化的目的是将亚铁离子氧化为铁离子,发生的主要反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为Cl2、HCl。 ;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,化学方程式为SO2+NaOH=NaHSO3;(2)根据题给流程知,酸溶的目的是将氧化铁转化为氯化铁,盐酸可抑制铁离子水解,酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解。(3)通氯气氧化的目的是将亚铁离子氧化为铁离子,发生的主要反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为Cl2、HCl。
考点:以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程为载体考查平衡常数表达式的书写、物质的分离和提纯。
本题难度:困难
5、选择题 在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是 2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
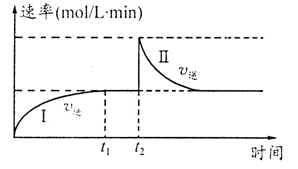
A.0~t2时,v正>v逆
B.t2时刻改变的条件可能是加催化剂
C.Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ
D.Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ
参考答案:C
本题解析: A、0~t1时,v正>v逆,t1~t2时,v正=v逆?;B、t2时刻改变的条件不可能是加催化剂,催化剂只改变速率,不改变平衡;D、化学平衡常数只跟温度有关,温度不变,化学平衡常数不变。
本题难度:一般
|