1、选择题 工业制硫酸的反应之一是:2SO2+O2
2SO3.如果反应在密闭容器中进行,下列说法错误的是( )
A.当SO2的物质的量不再改变时,该反应达到了平衡状态
B.达到平衡时,SO2的浓度与SO3的浓度一定相等
C.在给定条件下达平衡时,SO2的转化率达到了最大
D.使用V2O5催化剂是为了加快反应速率,提高生产效率
参考答案:A.当可逆反应达到平衡状态时,各物质的物质的量浓度不再改变,所以当SO2的物质的量不再改变时,该反应达到了平衡状态,故A正确;
B.当该反应达到平衡状态时,SO2的浓度与SO3的浓度可能相等,也可能不等,与反应物浓度及转化率有关,故B错误;
C.在给定条件下达平衡状态时,二氧化硫的正逆反应速率相等,所以SO2的转化率达到了最大,故C正确;
D.催化剂能增大反应速率,缩短反应时间,但不改变化学平衡状态移动,故D正确;
故选B.
本题解析:
本题难度:简单
2、填空题 (14分)
(1)已知:① N2(g) + O2(g)=2NO(g) △H=+179.5 kJ/mol
②2NO(g) + O2(g)=2NO2(g) △H=-112.3 kJ/mol
③2NO(g) +2CO(g)=N2(g) +2CO2(g) △H=-759.8 kJ/mol
NO2(g)+CO(g)=NO(g) +CO2(g) △H= kJ/mol。
(2)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,
进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
H2O
| CO
| CO
| H2
|
①
| 650
| 2
| 4
| 2.4
| 1.6
| 5
|
②
| 900
| 1
| 2
| 1.6
| 0.4
| 3
|
③
| 900
| a
| b
| c
| d
| t
|
①实验组①中以v(CO2)表示的反应速率为 ,此温度下的平衡常数为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、1mol CO、1 mol CO2和 2 molH2,若要使反应在开始
时 进行。(填“正向”、“逆向”)
③若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系
为α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
参考答案:(14分)
(1)-234(2分)
(2)① 0.16mol/(L·min) (2分) 8/3或2.67 (2分)减小 (2分)
②正向(2分)
③ 0.4mol(2分) =(2分)
本题解析:(1)根据盖斯定律可得该反应的?H=1/2?H1—1/2?H2+1/2?H3=-234kJ/mol。
(2)①实验组①中以v(CO2)=v(CO)=?c(CO)/?t =(4mol—2.4mol)÷2L÷5min=0.16mol/(L·min);平衡时c(CO)=2.4mol÷2L=1.2mol?L?1,c(CO2)=c(H2)=1.6mol÷2L=0.8mol?L?1,c(H2O)=(2mol—1.6mol)÷2L=0.2mol?L?1,则此温度下的平衡常数=v(CO2)? c(H2)/[ c(H2O)?c(CO)]= 8/3或2.67;根据表中数据,温度升高,反应物的转化率减小,所以温度升高时平衡常数会减小。
②若在此容器中开始充入2mol H2O(g)、1mol CO、1 mol CO2和 2 molH2,则浓度商Q=v(CO2)? c(H2)/[ c(H2O)?c(CO)]= 0.5mol/L×1mol/L/(1mol/L×0.5mol?L?1)=1,小于平衡常数,所以反应在开始时正向进行。
③第②组实验与第③组实验温度相同,则二者平衡常数相同,所以若a=2mol,b=1mol,则c=0.4mol,d=1.6mol;到达平衡时实验组②中H2O(g)和实验组③中CO的转化率相等。
考点:本题考查盖斯定律的应用、反应速率、化学平衡常数、化学平衡移动。
本题难度:困难
3、选择题 在容积为VL的密闭容器中放入2LA和1LB,3A(g)+B(g)  nC(g)+2D(g),达到平衡后,A物质的量减少1/2,混合气体的平均摩尔质量增大1/8,则该反应中n的值( )
nC(g)+2D(g),达到平衡后,A物质的量减少1/2,混合气体的平均摩尔质量增大1/8,则该反应中n的值( )
A. 1
B. 2
C. 3
D. 4

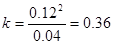 ,故A错误;N2O4的转化率为
,故A错误;N2O4的转化率为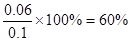 ,故B正确;前2s,NO2的平均反应速率为
,故B正确;前2s,NO2的平均反应速率为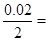 0.01mol·L-1·s-1,N2O4的平均反应速率为0.005mol·L-1·s-1,故C正确;2s时,NO2的物质的量0.1mol,反应的N2O4的物质的量0.05mol,剩余N2O4的物质的量0.45mol·L-1,在2s时,体系内压强为反应前的1.1倍,故D正确。
0.01mol·L-1·s-1,N2O4的平均反应速率为0.005mol·L-1·s-1,故C正确;2s时,NO2的物质的量0.1mol,反应的N2O4的物质的量0.05mol,剩余N2O4的物质的量0.45mol·L-1,在2s时,体系内压强为反应前的1.1倍,故D正确。