|
高中化学知识点大全《化学平衡》试题特训(2017年最新版)(八)
2017-11-11 02:12:19
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 两体积相同的密闭容器中均充入1mol?X和1mol?Y,分别在300℃和500℃下发生如下反应:X(g)+Y(g)

3Z(g),得到Z的含量随时间t变化的a,b两条曲线(如图所示).已知在t3时刻改变了某一实验条件,相关判断正确的是( )
A.曲线a是500℃时的图象
B.正反应是吸热反应
C.t3时刻可能是增大了压强
D.t3时刻可能是降低了温度
| 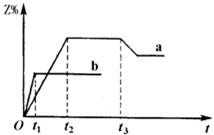
参考答案:C
本题解析:
本题难度:简单
2、选择题 某温度下,反应2CH3OH(g)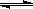 CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下: CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
| CH3OH
| CH3OCH3
| H2O
| 浓度/(mol·L-1)
| 0.44
| 0.6
| 0.6
|
下列说法正确的是 ( )
A.CH3OH的起始浓度为1.04 mol/L B. 平衡时CH3OH的浓度为0.04 mol/L
C.此时逆反应速率大于正反应速率 D.平衡时CH3OH的转化率小于80%
参考答案:B
本题解析:考查平衡常数的有关计算。根据表中数据可知,该时刻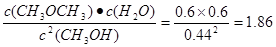 <400,所以此时正反应速率大于逆反应速率,C不正确。根据反应式可知甲醇的起始浓度是0.44mol/L+2×0.6mol/L=1.64mol/L,A不正确。设平衡时甲醚和水蒸气的物质的量浓度为x,则平衡时甲醇的浓度为(1.64mol/L-2x)。所以根据平衡常数的表达式可知 <400,所以此时正反应速率大于逆反应速率,C不正确。根据反应式可知甲醇的起始浓度是0.44mol/L+2×0.6mol/L=1.64mol/L,A不正确。设平衡时甲醚和水蒸气的物质的量浓度为x,则平衡时甲醇的浓度为(1.64mol/L-2x)。所以根据平衡常数的表达式可知 ,解得x=0.8mol/L,所以平衡时甲醇的浓度为1.64mol/L-2×0.8mol/L=0.04mol/L,B正确。甲醇的转化率为 ,解得x=0.8mol/L,所以平衡时甲醇的浓度为1.64mol/L-2×0.8mol/L=0.04mol/L,B正确。甲醇的转化率为 ,D不正确。答案选B。 ,D不正确。答案选B。
本题难度:一般
3、选择题 在某溶液中进行的反应:A+2B 3C。温度每升高10℃,其反应速率增大到原来的3倍,已知在20℃时v(A)="0.1" mol·L-1·min-1,当其他条件不变时,将温度升高到40℃时,则v(B)应等于(?) 3C。温度每升高10℃,其反应速率增大到原来的3倍,已知在20℃时v(A)="0.1" mol·L-1·min-1,当其他条件不变时,将温度升高到40℃时,则v(B)应等于(?)
A.0.6 mol·L-1·min-1? B.0.9 mol·L-1·min-1
C.1.2 mol·L-1·min-1? D.1.8 mol·L-1·min-1
参考答案:D
本题解析:因为反应中各物质表示的速率之比等于化学方程式中各物质的化学计量数之比,即v(A)∶v(B)=1∶2。已知,在20°C时,v(A)=0.1mol·L-1·min-1,则v(B)="2×v(A)=2×" 0.1mol·L-1·min-1 =0.2mol·L-1·min-1。
根据题意,其反应速率是每升高10°C就增大到原来的3倍,所以当温度从20°C升高到40°C时,v(B)应是0.2mol·L-1·min-1×32=1.8mol·L-1·min-1。
本题难度:简单
4、填空题 (1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
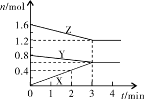
①该反应的化学方程式: ;
②反应开始至2min末,X的反应速率为 (mol·L-1·min-1);
③3min后图中曲线所表示的含义是 。
(2)(4分)下图为石油蒸馏的装置图,根据此图回答下列问题。

①温度计的水银球插在什么位置?
②蒸馏烧瓶中除了加入石油外还要加入什么?
③冷却水的流动方向如何?(填A或B,下题同)
A、a→b B、 b→a
④得到的汽油、煤油是纯净物吗?
A、是 B、不是
参考答案:(10分)(1)(6分)①Y+2Z 3X ②0.1 3X ②0.1
③在此条件下该反应已达到化学反应限度(或化学平衡)
(2)(4分)①温度计的水银球插在蒸馏烧瓶支管口处
②还要加入沸石或碎瓷片
③B、 ④B、
本题解析:(1)根据图像可知,反应进行到3min时,各种物质的物质的量不再发生变化,说明反应达到平衡状态。此时X增加了0.6mol,Y、Z分别减少0.2mol和0.4mol.应用物质的量的变化量之比是相应的化学计量数之比,因此方程式为Y+2Z 3X。反应开始至2min末,X的物质的量增加了0.4mol,所以其反应速率是 3X。反应开始至2min末,X的物质的量增加了0.4mol,所以其反应速率是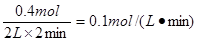 。 。
(2)①蒸馏时温度计测量的是气体的温度,所以温度计的水银球插在蒸馏烧瓶支管口处。
②在加热的条件下,液体容易剧烈跳动,所以需要加入碎瓷片防止暴沸。
③冷凝时水的流向应该和气体的流向相反,所以是b进a出,己答案选B。
④石油的分馏产物仍然是混合物,答案选B。
本题难度:一般
5、填空题 (12分)T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。
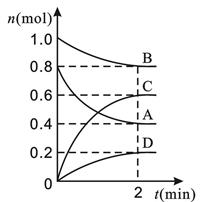
已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
(1)容器中反应的化学方程式为 。
(2)前2 min,v(A)=______________ mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是___________。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=_________________(保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是________(填选项字母)。
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
参考答案:(1)2A+B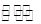 3C+D(3分,写“=”,扣1分) 3C+D(3分,写“=”,扣1分)
(2)0.4(2分)
(3)BD(2分,多选不给分,漏选1个扣1分)
(4)1.69(2分)
(5)C(2分,多选不给分)
本题解析:(1)根据所给信息分析,相同的时间内A减少了0.8-0.4=0.4摩尔,B减少了1.0-0.8=0.2摩尔,C增加了0.6-0=0.6摩尔,D增加了0.2-0=0.2摩尔,物质的量比等于化学方程式的系数比,所以AB为反应物,CD为生成物,方程式为:2A+B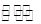 3C+D。(2)A的速率=(0.8-0.4)/0.5/2=0.4mol·(min·L)-1。(3)A、反应为前后气体的体积相等的反应,所以压强始终不变,所以压强不变不能说明反应已经达到平衡;B、由于反应中有非气体物质,所以混合气体的密度比不变说明反应达到平衡;C、消耗B和生成D都是说明正反应的速率,不能说明反应达到平衡;D、B的物质的量不变说明反应达到平衡。所以选BD。(4)平衡时A的浓度为0.4/0.5=0.8mol/L,B的浓度.8/0.5=1.6mol/L,C的浓度为0.6/.05=1.2mol/L,化学平衡常数=c(C)3/c(A)2c(B)=1.69。(5)A、只增加A的量,平衡正向移动,但A的转化率减小;B、移走一部分D,不影响平衡;C、升高温度,平衡正向移动,A的转化率增大;D、将体积缩小,平衡不移动。所以选C。 3C+D。(2)A的速率=(0.8-0.4)/0.5/2=0.4mol·(min·L)-1。(3)A、反应为前后气体的体积相等的反应,所以压强始终不变,所以压强不变不能说明反应已经达到平衡;B、由于反应中有非气体物质,所以混合气体的密度比不变说明反应达到平衡;C、消耗B和生成D都是说明正反应的速率,不能说明反应达到平衡;D、B的物质的量不变说明反应达到平衡。所以选BD。(4)平衡时A的浓度为0.4/0.5=0.8mol/L,B的浓度.8/0.5=1.6mol/L,C的浓度为0.6/.05=1.2mol/L,化学平衡常数=c(C)3/c(A)2c(B)=1.69。(5)A、只增加A的量,平衡正向移动,但A的转化率减小;B、移走一部分D,不影响平衡;C、升高温度,平衡正向移动,A的转化率增大;D、将体积缩小,平衡不移动。所以选C。
考点:化学平衡。
本题难度:困难
| 