1、填空题 (1)Mg(OH)2中混有的Al(OH)3的杂质可以用NaOH除去,请用离子方程式表示______
(2)Fe3+的检验用离子方程式表示______
(3)在配制硫酸亚铁溶液时,常常加入铁粉,请说明原因______(用离子方程式表示)
(4)硫化钠水溶液显______性(填酸、碱、中),原因______(用离子方程式表示)
(5)写出镁条在二氧化碳中燃烧的化学方程式______.
参考答案:(1)因氢氧化铝能溶解在NaOH溶液中,而氢氧化镁不能,Mg(OH)2中混有的Al(OH)3的杂质可以用NaOH除去的离子反应为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)利用KSCN溶液检验铁离子,溶液为血红色,离子反应为Fe3++3SCN- Fe(SCN)3或与碱反应生成红褐色沉淀,离子反应为Fe3++3OH-=Fe(OH)3,
Fe(SCN)3或与碱反应生成红褐色沉淀,离子反应为Fe3++3OH-=Fe(OH)3,
故答案为:Fe3++3SCN- Fe(SCN)3或Fe3++3OH-=Fe(OH)3;
Fe(SCN)3或Fe3++3OH-=Fe(OH)3;
(3)配制硫酸亚铁溶液时,常常加入铁粉,是因亚铁离子易被氧化,则加入铁发生2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(4)硫化钠水溶液中因硫离子水解使溶液显碱性,发生的离子反应为S2-+H2O HS-+OH-,故答案为:碱性;S2-+H2O
HS-+OH-,故答案为:碱性;S2-+H2O HS-+OH-;
HS-+OH-;
(5)Mg在二氧化碳中燃烧生成氧化镁和碳,发生的化学反应为2Mg+CO2点燃.2MgO+C,故答案为:2Mg+CO2点燃.2MgO+C.
本题解析:
本题难度:一般
2、填空题 工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC[Al2(OH)nCl6-n]的流程如下:
 ?
?
(1)粉碎煤矸石的目的是__________________________________________________;
滤渣Ⅰ的主要成分是________(填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中的有色离子为_____
________(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为_________;步骤①的煮沸装置上方需安装一长导管,长导管的作用是__________________________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是________
_______________________;已知BAC的分散质粒子大小在1~100 nm之间,由此区别滤液Ⅰ与BAC两种液体的物理方法是________________________;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式:_______________________
(4)若0.1 mol AlCl3在某温度下溶于蒸馏水,当有5%水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式:____________________________________。
参考答案:(1)增大反应物接触面积,加快溶解速率(提高Al3+的浸出率) SiO2
(2)Fe2+ 4Fe2++O2+4H+=4Fe3++2H2O 冷凝、回流 (3)除去Fe3+ 用一束光照射液体,观察是否有丁达尔效应 Al3++4OH-=AlO2—+2H2O
(4)AlCl3(aq)+3H2O(l) Al(OH)3(aq)+3HCl(aq)ΔH=+200a kJ·mol-1
Al(OH)3(aq)+3HCl(aq)ΔH=+200a kJ·mol-1
本题解析:(1)粉碎煤矸石能增大反应物的接触面积,加快反应速率;SiO2不溶于盐酸和硫酸,滤渣Ⅰ的主要成分是SiO2。(2)溶液中的Fe2+为绿色;Fe2+很容易被空气中的O2氧化成棕黄色的Fe3+,离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;煮沸装置上方的长导管有冷凝、回流的作用。(3)步骤②中加入适量的Ca(OH)2并控制pH,使Fe3+生成Fe(OH)3,从而除去Fe3+;BAC的分散质粒子大小在1~100 nm之间,属于胶体,可以用丁达尔效应区别滤液Ⅰ与BAC两种液体;若Ca(OH)2溶液过量,部分Al3+生成AlO2—,离子方程式为Al3++4OH-=AlO2—+2H2O。
(4)根据题意:AlCl3 ~ ΔH
1 mol? ΔH
0.1 mol×5%?+a kJ·mol-1
则ΔH=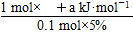 =+200a kJ·smol-1,其热化学方程式为AlCl3(aq)+3H2O(l)
=+200a kJ·smol-1,其热化学方程式为AlCl3(aq)+3H2O(l) Al(OH)3(aq)+3HCl(aq) ΔH=+200a kJ·mol-1。
Al(OH)3(aq)+3HCl(aq) ΔH=+200a kJ·mol-1。
本题难度:困难
3、选择题 下列离子方程式书写正确的是( )
A.用氨水吸收少量SO2:NH3?H2O+SO2=NH4++HSO3-
B.用两个铜片作电极电解盐酸:Cu+2H+
H2↑+Cu2+
C.含0.1molFeBr2的溶液中通入0.1molCl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O
参考答案:A、用氨水吸收少量SO2的离子方程式为:2NH3?H2O+SO2=2NH4++SO32-+H2O,过量SO2时得到的是亚硫酸氢盐,故A错误;
B、电解池中,金属铜作阳极时,铜电极本身失去电子,阴极是盐酸中的氢离子放电,故电解原理方程式为Cu+2H+?电解?.?H2↑+Cu2+,故B正确;
C、还原性:Fe2+>Br-,氯气先氧化0.1mol亚铁离子,消耗氯气0.05mol,氯气还继续氧化溴离子,但是氯气的量相对于溴离子不足,溴离子剩余.反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故C错误;
D、碳酸氢钙溶液中加入足量烧碱溶液似的反应为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故D错误.
故选B.
本题解析:
本题难度:简单
4、填空题 高锰酸钾在实验室和工农业生产中有广泛的用途.实验室以二氧化锰为主要原料制备高锰酸钾。其部分流程如下:

(1)第①步加热熔融应在?中进行.而不用瓷坩埚的原因是?(用化学程式表示)。
(2)第④步通入CO2,可以使Mn片发生反应.生成MnO4—和MnO2。反应的离子方程式为?。则完成反应时,转化为KMnO4的占全部K2MnO4的百分率约为?(精确到0.1%)。
(3)第⑤步趁热过滤的是?。
(4)第⑥步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、?、洗涤、干燥。干燥过程中.温度不宜过高.其原因是?(用化学方程式表示)。
(5)H2O2和KMnO4,都是常用的强氧化剂。若向H2O2溶液中滴加酸性高锰酸钾溶液.则酸性高锰酸钾溶液会褪色.写出该反应的离子方程式:?.该反应说明H2O2的氧化性比KMnO4?(填“强”或“弱”)。
参考答案:(1)铁坩埚;SiO2+2KOH K2SiO3+H2O
K2SiO3+H2O
(2)3MnO42-+2CO2 2MnO4-MnO2↓+2CO32-(或其他合理答案);66.7%
2MnO4-MnO2↓+2CO32-(或其他合理答案);66.7%
(3)减少过滤的损耗(或防止降温过程中KMnO4析出而损耗)
(4)过滤;2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(5)2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O;弱
本题解析:(1)由于KOH是强碱,在加热及高温时容易与玻璃、陶瓷中的SiO2发生反应,该反应的方程式为:SiO2+2KOH K2SiO3+H2O。所以加热熔融KClO3和KOH的混合物应在铁坩埚中进行。(2)根据题意结合原子守恒和电荷守恒,可得该反应的方程式为:3MnO42-+2CO2
K2SiO3+H2O。所以加热熔融KClO3和KOH的混合物应在铁坩埚中进行。(2)根据题意结合原子守恒和电荷守恒,可得该反应的方程式为:3MnO42-+2CO2 2MnO4-+MnO2↓+2CO32-。由方程式可看出,每有3mol的K2MnO4发生反应,就生成2mol的KMnO4。所以转化为KMnO4的K2MnO4的转化率为:2÷3×100%=66.7%。(3)由于KMnO4的溶解度随温度的升高而增大,随温度的降低而减小。趁热过滤就可以减少过滤过程中KMnO4的损耗。(4)第⑥?步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、过滤、洗涤、干燥。KMnO4受热容易发生分解反应:2KMnO4
2MnO4-+MnO2↓+2CO32-。由方程式可看出,每有3mol的K2MnO4发生反应,就生成2mol的KMnO4。所以转化为KMnO4的K2MnO4的转化率为:2÷3×100%=66.7%。(3)由于KMnO4的溶解度随温度的升高而增大,随温度的降低而减小。趁热过滤就可以减少过滤过程中KMnO4的损耗。(4)第⑥?步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、过滤、洗涤、干燥。KMnO4受热容易发生分解反应:2KMnO4 K2MnO4+MnO2+O2↑。为了防止KMnO4的分解,所以在干燥时温度不宜过高。(5)KMnO4和H2O2都有强的氧化性,但KMnO4的氧化性更强,所以二者发生反应时H2O2作还原剂,把KMnO4还原为无色的Mn2+,而使溶液褪色。该反应说明H2O2的氧化性比KMnO4弱。
K2MnO4+MnO2+O2↑。为了防止KMnO4的分解,所以在干燥时温度不宜过高。(5)KMnO4和H2O2都有强的氧化性,但KMnO4的氧化性更强,所以二者发生反应时H2O2作还原剂,把KMnO4还原为无色的Mn2+,而使溶液褪色。该反应说明H2O2的氧化性比KMnO4弱。
本题难度:一般
5、选择题 用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合离子方程式2H++S
═H2O+SO2↑的反应个数有( )
A.4个
B.5个
C.8个
D.12个
参考答案:亚硫酸的钾盐、钠盐、钡盐中,BaSO3不溶于水,离子方程式中不能用SO32-表示,其余在溶液中均可用SO32-表示;
四种酸中,醋酸是弱酸,离子方程式中不能用H+表示,HNO3有强氧化性,与SO32-反应时生成SO42-,离子方程式也不符合,
则符合2H++SO32-═SO2↑+H2O,所以钾盐、钠盐与硫酸、盐酸可组合出4个反应,且离子方程式相同,
故选A.
本题解析:
本题难度:简单