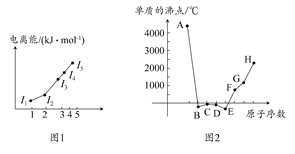
1、填空题 (1)图1为元素X的前五级电离能的数值示意图。已知X的原子序数<20,请写出X基态原子的核外电子排布式?。
(2)A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图2所示。
请回答:
①上述元素中,某些元素的常见单质所形成的晶体为分子晶体,这些单质分子中既含有σ键又含有π键的是?(填化学式)。
②已知D、F、G三种元素的离子具有跟E相同的电子层结构,则B、C、D三种元素的第一电离能由大到小的顺序为(用相关元素符号表示)?。
③已知H的电负性为1.5,而氯元素的电负性为3.0,二者形成的化合物极易水解,且易升华。据此推测该化合物的化学键类型为?。
④原子序数比A小1的元素与D元素形成的化合物的空间构型为?,中心原子的杂化方式为?。
参考答案:(1)1s22s22p63s2
(2)①N2、O2?②F>N>O?③极性共价键?④平面三角形? sp2
本题解析:(1)根据图1中X的前五级电离能,从其第三电离能开始突增,因此其最外层有两个电子,故X为Mg(注意Be原子只有4个电子,没有第五电离能),其基态原子的核外电子排布式为1s22s22p63s2。
(2)根据图2中元素单质的沸点,可知A、B、C、D、E、F、G、H为C、N、O、F、Ne、Na、Mg、Al。①单质形成的晶体为分子晶体的有N2、O2、F2、Ne等,其中N2、O2中既含有σ键又含有π键。②B、C、D三种元素分别为N、O、F,第一电离能大小顺序为:F>N>O(注意N、O电离能反常)。③Al、Cl形成的化合物为AlCl3,根据其化合物的物理性质,可以推断其含有共价键。④原子序数比A小1的元素为N,与F元素可形成化合物NF3,为平面三角形结构,中心原子N的杂化方式为sp2。
本题难度:一般
2、选择题 放射性同位素铀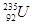 的原子核内的中子数是
的原子核内的中子数是
A.51
B.92
C.143
D.235
参考答案:C
本题解析:考查原子的组成及表示方法。在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以中子数是235-92=143,答案选C。
本题难度:简单
3、选择题 按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便.下列各组物质中,符合“酸-碱-盐-氧化物”顺序排列的是
A.CuO?H2SO4?Mg(OH)2?MgCl2
B.CO2?H2CO3?Na2CO3?Ca(HCO3)2
C.HNO3?NH3?H2O?NH4NO3?H2O
D.NaHSO4?NaOH?Na2SO4?SO3
参考答案:C
本题解析:分析:酸是指电离时生成的阳离子全部是氢离子的化合物;
碱是指电离时生成的阴离子全部是氢氧根离子的化合物;
盐是指由金属离子和酸根离子组成的化合物;
氧化物是由两种元素组成,并且一种元素是氧元素的化合物.
解答:A、氧化铜属于氧化物,硫酸属于酸,氢氧化镁属于碱,氯化镁属于盐,故A错误;
B、二氧化碳属于氧化物,碳酸属于酸,碳酸钠属于盐,碳酸氢钙属于盐,故B错误;
C、硝酸属于酸,一水合氨属于碱,硝酸铵属于盐,水属于氧化物,故C正确;
D、硫酸氢钠属于盐,氢氧化钠属于碱,硫酸钠属于盐,三氧化硫属于氧化物,故D错误;
故选C.
点评:本题考查了物质分类的应用,解答本题要充分理解物质的分类方法方面的内容,只有这样才能对各种物质进行正确的分类.
本题难度:简单
4、选择题 下列各组中,属于同位素的是(?)
A.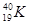 和
和
B.金刚石和石墨
C.H2O和D2O
D.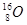 、
、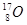 和
和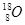
参考答案::D
本题解析:同位素是指质子数相同而中子数不同的同一元素的不同原子。
A组不是同种元素原子,仅仅质量数相同。
B组是同素异形体。
C组是由同种元素(H)不同原子构成的物质。
点评:要注意化学概念中的“四同”:结构相似,在分子组成上相差1个或几个CH2原子团的物质,互称为同系物;同分异构体简称异构体,是具有相同分子式而分子中原子排列不同的化合物,举例:正丁烷与异丁烷;同素异形体是相同元素构成不同形态的物体,举例:氧气和臭氧;同位素:具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素,举例:碳12和碳14。
本题难度:简单
5、选择题 下列物质中属于非电解质的是
A.固体氯化钾
B.液态氯化氢
C.气体二氧化碳
D.作电极的碳棒
参考答案:C
本题解析:分析:非电解质指:水溶液中和熔融状态下都不能够导电的化合物,否则为电解质;蔗糖、乙醇等都是非电解质;单质,混合物既不是电解质,也不是非电解质;据此即可解答.
解答:A.固体氯化钾在水溶液里或熔化状态下,能电离出自由移动的阴阳离子,导致溶液导电,所以固体氯化钾是电解质,故A错误;
B.液态氯化氢,是纯净物,氯化氢水溶液能导电,是由于电离出自由移动的氢离子和氯离子,氯化氢是化合物,属于电解质,故B错误;
C.二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子,所以二氧化碳的水溶液导电,但电离出离子的物质是碳酸不是二氧化碳自身电离,所以二氧化碳是非电解质,故C正确;
D.作电极的碳棒是单质,不是化合物,所以不是电解质,也不是非电解质,故D错误;
故选C.
点评:本题主要考查非电解质的概念,注意电解质和非电解质都必须是化合物,非电解质能导电是溶于水溶液中和在熔融状态下都不能自身电离,单质和混合物既不是电解质也不是非电解质,题目较简单.
本题难度:困难