1、计算题 为了测定某铜银合金的成分,将30.0 g合金溶于80 mL 13.5 mol·L-1的浓HNO3中,待合金完全溶解后,收集到气体6.72 L (标准状况),并测得溶液中c(H+)=1mol·L-1。假设反应后溶液的体积仍为80 mL,试计算:
(1)被还原的HNO3的物质的量;
(2)合金中银的质量分数。
参考答案:(1) 0.3 mol?(2)36%
本题解析:(1) HNO3被还原生成NO 或NO2气体 , 因此产生的气体的物质的量即是被还原的HNO3的物质的量。
n = 6.72 L/ 22.4L·mol-1=0.3mol
(2)反应后溶液中c(H+)= 1mol·L-1, 说明硝酸过量。
参加反应的HNO3为 (13.5mol·L-1 -1mol·L-1)×0.08L=1mol,
设合金中Cu的物质的量为x, Ag的物质的量为y则得:
64 g/mol x+108 g/mol y =30.0 g
2 x+y+0.3 mol=1 mol
解得: x=0.3mol?y=0.1mol
则合金中银的质量分数为:(0.1mol×108g/mol)/30.0g =36%
本题难度:简单
2、实验题 铁及其化合物在生产和生活中有着广泛的应用。
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
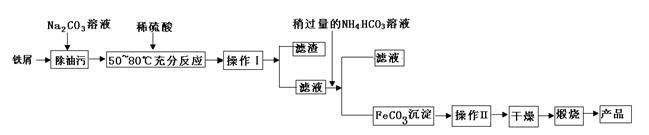
①操作Ⅰ、Ⅱ的名称分别是____、____。
②写出在空气中煅烧FeCO3的化学方程式?;
③煅烧如果不充分,产品中将有Fe2+存在,试设计实验检验产品中有无Fe2+。
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;量取25.00mL待测溶液于锥形瓶中;用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式?
②计算上述样品中FeSO4·7H2O的质量分数为?[已知M(FeSO4·7H2O)=278g/mol]
③滴定达到终点时锥形瓶中溶液颜色变化为?
④下列操作会导致样品中FeSO4·7H2O的质量分数的测定结果偏高的有_____________。
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗?
c.?滴定终点时滴定管尖嘴中产生气泡?
d.量取待测液,视线注视刻度时开始平视、结束俯视
参考答案:(1)①过滤、洗涤(各1分)
②4FeCO3+O2 2Fe2O3+4CO2(2分)
2Fe2O3+4CO2(2分)
③取固体样品少许放置试管中,加入足量稀硫酸,振荡试管,再加入几滴KMnO4溶液。如果溶液褪色,则有Fe2+?(3分)
(2)①5Fe2++MnO4-+8H+=Fe3++2Mn2++4H2O(2分)
②0.9754(2分)
③溶液由浅绿色变成紫红色,且半分钟内不立即退去(2分)
④b d(2分)
本题解析:(1)①操作I后得到滤渣和滤液,所以应为过滤,沉淀干燥前应先洗涤除去杂质。②+2价铁在空气中加热易被氧化为+3价,即Fe2O3。③检验Fe2+可以选用氧化剂,为了使现象更加明显可选用KMnO4。(2)②计算时注意取的待测溶液是25 mL,所以最后FeSO4·7H2O)质量分数=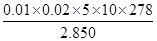 =0.9754。④a项,锥形瓶内有水对结果无影响,b项,滴定管未润洗相当于将标准液稀释,所用标准液体积增大,故结果偏高;c项,终点时产生气泡,读取体积偏小,结果偏低;d项,取待测液结束时俯视导致所取待测液体积偏大,消耗标准液体积偏大,结果偏高。
=0.9754。④a项,锥形瓶内有水对结果无影响,b项,滴定管未润洗相当于将标准液稀释,所用标准液体积增大,故结果偏高;c项,终点时产生气泡,读取体积偏小,结果偏低;d项,取待测液结束时俯视导致所取待测液体积偏大,消耗标准液体积偏大,结果偏高。
本题难度:一般
3、选择题 把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离子
A.是Fe3+和Cu2+
B.是Fe2+和Cu2+
C.是Fe2+和Fe3+
D.只有Fe2+
参考答案:D
本题解析:表面的氧化物的量较少,溶于盐酸后,生成的Cu2+和Fe3+也较少,分别被单质铁还原为Cu和Fe2+,铜与盐酸不反应,铁与盐酸反应生成Fe2+。
本题难度:简单
4、填空题 人类生活离不开化学,硫酸亚铁、醋酸、小苏打、食盐、次氯酸钙、氢氧化铝都是生活中较常见的化学物质。
(1)医疗上常用_____________(从上述物质中选,填化学式)糖衣片治疗贫血病,外面包裹糖衣的目的是?;
(2)治疗胃酸过多的药物主要成分是氢氧化铝或碳酸氢钠,请分别写出中和胃酸的离子方程式:____________________、 ? ___________________________;
(3)生活中的食醋和淀粉溶液分别属于分散系中的溶液和?,用?可以鉴别(填化学专用名词)。
参考答案:⑴FeSO4(1分); 防止亚铁离子被氧化 (1分)?;
⑵ Al(OH)3+3H+==Al3++3H2O (2分) 、? HCO3- +H+="==" H2 O + CO2↑(2分);
(3)胶体?丁达尔效应(每空1分)
本题解析:略
本题难度:一般
5、选择题 铁片放入下列溶液中,反应时无气体放出,取出后铁片质量减轻,则该溶液是
A.稀硫酸
B.CuSO4
C.AgNO3
D.Fe2(SO4)3
参考答案:D
本题解析:铁和稀硫酸反应生成硫酸亚铁和氢气;和硫酸铜反应生成硫酸亚铁和铜,铁片的质量增加;铁和硝酸银溶液反应,生成硝酸亚铁和银,铁片的质量增加;铁和硫酸铁反应生成硫酸亚铁,铁片的质量减少,答案选D。
点评:该题是高考中的常见考点之一,主要是检验学生对铁单质化学性质的熟悉掌握程度,以及灵活运用知识的能力。
本题难度:一般