1、选择题 反应4NH3(g) + 5O2(g)  ?4NO(g) + 6H2O(g)?在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率x
?4NO(g) + 6H2O(g)?在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率x
A. (O2) =" 0.01mol·(L·s)" –1? B. (NO) =" 0.002mol·(L·s)" –1
C. (H2O) =" 0.006mol·(L·s)" –1? D . (NH3) =" 0.008mol·(L·s)" –1
. (NH3) =" 0.008mol·(L·s)" –1
参考答案:B
本题解析:略
本题难度:简单
2、选择题 在化工生产中,如果再加快反应速率,应该优先考虑的科研方向是( )
A.提高设备强度,以便加压
B.选择适宜的催化剂
C.采用高温
D.用块状反应物代替粉末状反应物
参考答案:B
本题解析:由于催化剂可以成千上万倍的加快反应速率,因此优先考虑的科研方向是催化剂。所以答案选B。
本题难度:一般
3、选择题 实验室用锌与2mol/L盐酸溶液制取氢气,下列措施能使反应速率降低的是?
A.用锌粉代替锌块
B.改用1.5mol/L硫酸溶液
C.改用1mol/L硝酸溶液
D.向该硫酸溶液中加入等体积的水
参考答案:D
本题解析:
本题难度:一般
4、填空题 在某条件下,容器中有如下平衡反应:A+4B 2C+D,正反应为放热反应。此时,A、B、C的物质的量均为a mol,而D的物质的量为d mol。
2C+D,正反应为放热反应。此时,A、B、C的物质的量均为a mol,而D的物质的量为d mol。
(1)改变a的取值,再通过改变反应条件,可以使反应重新达到平衡。并限定达到新的平衡时,D的物质的量只允许在d/2到2d之间变化,则a的取值范围应是_______(用a和d的关系式表示)。
(2)如果要使本反应重新建立的平衡中,D的物质的量只允许在d到2d之间取值,则应该采取的措施是_______(从下列给出的选项中选择)。
A.升高反应温度
B.增大反应容器内的压强
C.增大反应容器的容积
D.降低反应温度
E.减小反应容器内的压强
F.减小反应容器的容积
参考答案:(1)a>4d(2)D
本题解析:(1)要使D的物质的量由d mol→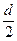 mol,需使平衡左移,且需C为d mol,此时,只需a>d即可;要使D的物质的量由d mol→2d? mol,需使平衡右移,此时需A d mol,需B 4d mol。因此,a应大于4 d,所以,a的取值范围为a>4d。
mol,需使平衡左移,且需C为d mol,此时,只需a>d即可;要使D的物质的量由d mol→2d? mol,需使平衡右移,此时需A d mol,需B 4d mol。因此,a应大于4 d,所以,a的取值范围为a>4d。
(2)由于没标明四种物质的状态,所以,只有降温。
本题难度:简单
5、选择题 将5.6g铁粉投入100mL2mol/L的稀硫酸中,2min时铁刚好完全溶解(忽略溶液体积变化)。下列有关这个反应的反应速率表示正确的是(?)
A.铁的反应速率为0.5mol/(L·min)
B.硫酸的反应速率为0.5mol/(L·min)
C.硫酸亚铁的反应速率为0.5mol/(L·min)
D.氢气的反应速率为0.5mol/(L·min)
参考答案:BC
本题解析:铁是固体,不能用来表示反应速率,A不正确。5.6g是0.1mol,消耗稀硫酸是0.1mol,生成硫酸亚铁是0.1mol,所以二者的反应速率都是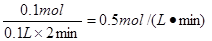 ,BC正确。用于氢气逸出,不在溶液中,无法计算,答案选BC。
,BC正确。用于氢气逸出,不在溶液中,无法计算,答案选BC。
本题难度:简单