1、选择题 反应C(s)+H2O(g)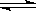 CO(g)+ H2(g)在一密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是(?)
CO(g)+ H2(g)在一密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是(?)
A.保持体积不变,增加H2O(g)的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2(N2不参加反应)使体系压强增大
D.保持压强不变,充入N2(N2不参加反应)使容器体积变大
参考答案:C
本题解析:A错,保持体积不变,增加H2O(g)的物质的量反应速率加快;B错,将容器的体积缩小一半即增大压强,化学反应速率加快;C正确;D错,保持压强不变,充入N2(N2不参加反应)体系的容积增大,各组分浓度减少,反应速率减慢;
本题难度:一般
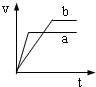
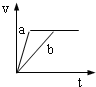
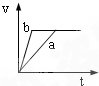
2、选择题 将等质量且过量的两份锌粉a、b中分别加入相同体积、相同物质的量浓度的稀硫酸,同时向a中加入少量硫酸铜溶液,下列各图产生H2的体积V(L)与时间t(min)的关系中正确的是( )
A.
B.
C.
D.
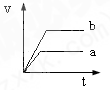
参考答案:由题意可知,反应均发生Zn+2H+═Zn2++H2↑,Zn过量,则相同体积、相同物质的量浓度的稀硫酸完全反应,生成氢气相同,
且a中加入少量硫酸铜溶液,构成Cu、Zn原电池,加快反应的速率,所以a反应速率快,达到反应结束时的时间短,显然只有B图象符合,
故选B.
本题解析:
本题难度:简单
3、选择题 下图表示反应

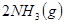 ;
;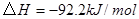 。在某段时间
。在某段时间 中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
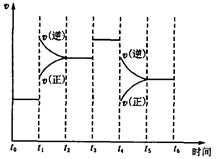
A.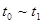
B.
C.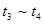
D.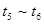
参考答案:A
本题解析: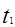 时刻改变条件,逆向速率大于正向,所以平衡逆向移动,氨的百分含量减小。
时刻改变条件,逆向速率大于正向,所以平衡逆向移动,氨的百分含量减小。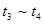 平衡没有发生移动。
平衡没有发生移动。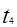 之后,逆向速率大于正向,平衡继续逆向移动,其含量继续减小。所以最初的平衡状态氨的百分含量最高
之后,逆向速率大于正向,平衡继续逆向移动,其含量继续减小。所以最初的平衡状态氨的百分含量最高
本题难度:一般
4、选择题 下列有关说法中正确的是( )
A.合成氨中采用及时分离氨气提高反应物的转化率
B.升高温度能使吸热反应速率加快,使放热反应速率减慢
C.增大压强,化学反应速率一定加快,平衡一定发生移动
D.化学反应必然引起物质状态的变化
参考答案:A.分离出氨气,降低生成物的浓度,平衡正向移动,所以提高反应物的转化率,故A正确;
B.升高温度使化学反应速率加快,与反应的热效应无关,故B错误;
C.对气体参加的反应,增大压强,反应速率加快,若反应速率不变或同等程度的变化,化学平衡不移动,故C错误;
D.化学反应中物质的状态不一定变化,如合成氨的反应,反应物与生成物均为气体,故D错误;
故选A.
本题解析:
本题难度:一般
5、实验题 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、、18.4mol/LH2SO4
A:甲同学研究的实验报告如下表:
实验步骤
| 现象
| 结论
|
①分别取等体积的2mol/L的硫酸于试管中
②
| 反应速率镁>铁,铜不反应
| 金属的性质越活泼,反应速率越快
|
(1)甲同学表中实验步骤②为 。
(2)甲同学的实验目的是 ;要得出正确的实验结论,还需控制的实验条件是 。B:乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行实验

(3)乙同学在实验中应该测定的数据是 。
(4)乙同学完成该实验应选用的实验药品 。该实验中不选用某浓度的硫酸,理由是 。
参考答案:(1)分别投入大小、形状相同的铜、铁、镁
(2)研究金属本身的性质与反应速率的关系 温度相同
(3)一定时间内产生气体的体积(或产生一定体积的气体所需的时间)
(4)镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4 常温下,镁与18.4mol/LH2SO4反应产生SO2,使对比实验的反应原理不同。18.4mol/LH2SO4使铁钝化
本题解析:(1)要比较不同的金属与硫酸反应的快慢时,三种金属的大小、形状相同应该是相同的,即答案应该是分别投入大小、形状相同的铜、铁、镁。
(2)由于三种金属是不同的,所以实验目的是研究金属本身的性质与反应速率的关系。比较不同的金属与硫酸反应的快慢时,处理硫酸的浓度、固体的表面积相同以外,溶液的温度应该是相同的。
(3)要比较浓度不同的硫酸与同一种金属反应的反应速率快慢,可以通过测量一定时间内产生气体的体积(或产生一定体积的气体所需的时间)。
(4)由于是比较不同浓度的硫酸与金属反应的快慢,所以选择的试剂应该是镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4。由于常温下,镁与18.4mol/LH2SO4反应产生SO2,使对比实验的反应原理不同,而18.4mol/LH2SO4使铁钝化,所以不能选择浓硫酸。
考点:考查影响化学反应速率的因素。
点评:探究性实验的一般思路
1、准确地把握实验目的。
2、利用已学知识,分析如何实现这个目的--实验原理。
3、结合实验材料,初步确定设计对策--实验方案。
本题难度:一般