1、选择题 下列关于金属腐蚀的说法中不正确的是(?)
A.金属腐蚀的本质是金属原子失去电子而被氧化
B.金属腐蚀一般包括化学腐蚀和电化学腐蚀
C.钢铁在酸性环境中会发生吸氢腐蚀
D.纯的金属一般难以发生电化学腐蚀
参考答案:C
本题解析:钢铁在酸性环境中会发生析氢腐蚀,选项C不正确,其余选项都是正确的,答案选C。
点评:该题是基础性试题的考查,主要是考查学生对金属腐蚀的熟悉了解程度,旨在巩固,提高学生的应试能力,难度不大,记住即可。
本题难度:简单
2、选择题 为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如下图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是?

[? ]
A.实验结束时,装置(1)左侧的液面一定会下降
B.实验结束时,装置(1)左侧的液面一定比装置(2)的低
C.实验结束时,铁钉b腐蚀最严重
D.实验结束时,铁钉c几乎没有被腐蚀
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列事实不能用电化学理论解释的是( )
A.镀锌铁比镀锡铁更耐用
B.铝制品不需要采用特殊方法保护
C.轮船吃水线以下的船壳上装有一定数量的锌块
D.钢铁在潮湿空气中比在干燥空气中腐蚀得快
参考答案:A、镀锌铁发生金属被腐蚀现象时,因Zn比Fe活泼,Zn被腐蚀,镀锡铁破损后发生电化腐蚀,因Fe比Sn活泼,因而是铁被腐蚀.所以,镀锌铁比镀锡铁耐用.发生原电池反应而可用电化学知识解释,故A不选.
B、铝因在空气中被O2氧化,使铝表面形成一层致密的氧化物薄膜而保护内层的铝不再被氧化,所以铝不用特殊方法保护,此现象与电化学知识无关,故B选.
C、轮船水线下的船壳装上锌块后,可保护船壳在海水中不被腐蚀,因为Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳,发生原电池反应可用电化学知识解释,故C不选.
D、钢铁在潮湿的环境中能构成原电池而被腐蚀,在干燥的环境中不能构成原电池,所以不易被腐蚀,所以发生原电池反应可用电化学知识解释,故D不选.
故选B.
本题解析:
本题难度:简单
4、填空题 (1)金属腐蚀一般可分为化学腐蚀和______腐蚀.
(2)炒过菜的铁锅未及时洗净容易发生腐蚀.
①若铁锅内残液呈弱酸性,则腐蚀主要属于______(填“吸氧”或“析氢”,下同)腐蚀;若残液中主要含有NaCl,腐蚀应主要属于______腐蚀.
②吸氧腐蚀中,负极的电极反应式为______.铁锈中铁的化合价为______.
(3)如果在铁的表面镀上一层铜,就可以防止铁生锈,则在电镀过程中铁为______极,电极反应式为______,铜为______极,电极反应式为______.
参考答案:(1)金属的腐蚀分为:金属和化学物质直接反应的是化学腐蚀,金属和电解质溶液构成原电池的是电化学腐蚀,
故答案为:电化学;
(2)①若铁锅内残液呈弱酸性,铁作负极,碳作正极,铁失去电子被氧化,正极上氢离子得电子生成氢气,所以是析氢腐蚀;若残液中主要含有NaCl,铁作负极,碳作正极,铁失去电子被氧化,正极上氧气得电子和水反应生成氢氧根离子,所以发生的是吸氧腐蚀,
故答案为:析氢;吸氧;
②吸氧腐蚀中,铁作负极,铁失去电子被氧化,所以负极的电极反应式为Fe-2e-=Fe2+;正极上氧气得电子和水生成氢氧根离子,亚铁离子和氢氧根离子生成氢氧化亚铁,氢氧化亚铁被氧化生成氢氧化铁,氢氧化铁脱水形成铁锈,所以铁锈中铁的化合价是+3价,
故答案为:Fe-2e-=Fe2+;+3;
(3)电镀时,镀层作阳极,镀件作阴极,所以在铁的表面镀上一层铜,铁作阴极,电极反应式为:Cu2++2e-=Cu;铜作阳极,阳极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,故答案为:阴;Cu2++2e-=Cu;阳;Cu-2e-=Cu2+.
本题解析:
本题难度:一般
5、填空题 (15分)对下图中两极加以必要的连接并填空:
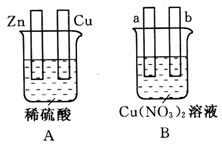
(1)在图A中,使铜片上产生氢气。
①若加以导线连接,则连接后的装置叫?(填“原电池”或“电解池”)。锌片发生?(填“氧化”或“还原”);铜片上的电极反应式:?。
②若外加电源,则连接后的装置叫?(填“原电池”或“电解池”),其中铜片作为该装置的?极,连接电源的?极;锌片上发生的电极反应式为?。
(2)在图B中,使a极析出铜。
①若a、b电极均为石墨电极并加以必要的连接,则连接后的装置应为?(填“原电池”或“电解池”);该装置工作时,溶液中阴离子向?极作定向移动(填“a”或“b”);经过一段时间后,停止反应并搅匀溶液,溶液的酸性??(填“增强”、“降低”或“不变”)。
②若a、b电极加以导线连接,且a极为铜电极,则b极可以为?电极(填序号)。
A.铂
B.铁
C.石墨
D.银 E.锌