1、填空题 如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
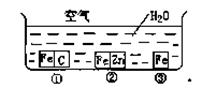
(1)金属腐蚀主要分为?腐蚀和?腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是?(填序号)。
(3)②中正极的电极反应式为?,
负极的电极反应式为?,
③中负极的电极反应式为?。
参考答案:(1)化学;电化学?(2)①>③>②
(3)2H2O + O2 + 4e-=4OH-;? Zn - 2e-=Zn2+?。?Fe - 2e-=Fe2+
本题解析:金属腐蚀有金属与接触到的物质直接发生化学反应引起的化学腐蚀和金属与接触到得电解质溶液因发生电化学反应而引起的电化学腐蚀这两类。金属腐蚀主要是电化学腐蚀。电化学腐蚀又分为析氢腐蚀和吸氧腐蚀两类。①②是电化学腐蚀;③是化学腐蚀。在①中铁作负极,失去电子。在②中锌作负极,失去电子,对铁来说起到了保护作用。所以铁被腐蚀的速率由快到慢的顺序是①>③>②。其中的电极式是②中正极为2H2O + O2 + 4e-=4OH-;负极的电极反应式为Zn-2e-=Zn2+③中负极Fe-2e-=Fe2+
本题难度:一般
2、选择题 下列防止金属腐蚀的做法不可行的是( )
A.在某些工具的机械转动部位刷油漆以防锈
B.衣架和电线外面包上一层塑料层以防锈
C.在钢材制造的大型船舶上装上一定数量的锌块
D.自行车的钢圈和车铃上镀上一层铬
参考答案:A、在某些工具的机械转动部位刷油漆,由于机械转动部位产生摩擦会使油漆很快脱落,不能起到保护金属的作用,故A错误;
B、衣架和电线外面包上一层塑料层以防锈,可以防止金属与空气接触,能防止金属被腐蚀,故B正确;
C、在钢材制造的大型船舶上装上一定数量的锌块,Fe、Zn形成原电池时,Fe作正极被保护,故C正确;
D、自行车的钢圈和车铃上镀上一层铬,能防止金属与空气接触,可以防止生锈,故D正确;
故选A.
本题解析:
本题难度:简单
3、选择题 利用下图装置可以模拟铁的电化学防护。下列说法不正确的是
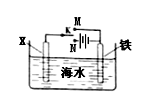
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁极发生氧化反应
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,X极发生氧化反应
参考答案:B
本题解析:若X为锌棒,开关K置于M处,形成原电池,锌作负极,发生氧化反应;铁做正极被保护,故A正确,B不正确。若X为碳棒,开关K置于N处,形成电解池,铁作阴极,被保护,可减缓铁的腐蚀,C正确;X极作阳极,发生氧化反应,D正确。
故选B
本题难度:一般
4、填空题 如图所示,烧杯中都盛有稀硫酸。
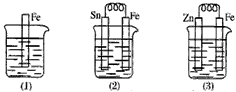
(1)(1)中反应的离子方程式为_____________________。
(2)(2)中反应的电极反应:Fe:_____________________,Sn:_____________________,Sn极附近溶液的pH___________(填“增大”、“减小”或“不变”)。
(3)(3)中被腐蚀的金属是___________,其电极反应式为_____________________。比较图(1)(2)(3)中纯铁被腐蚀的速率由快到慢的顺序是_____________________。
参考答案:(1)Fe+2H+==Fe2++H2↑
(2)Fe-2e-==Fe2+;2H++2e-==H2↑;增大
(3)Zn;Zn-2e-==Zn2+;(2)>(1)>(3)
本题解析:
本题难度:一般
5、选择题 下列叙述不正确的是( )
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH-
D.工业上电解饱和食盐水的阳极反应:2Cl--2e-=Cl2
参考答案:A、铁表面镀锌,镀层是锌,应作阳极;镀件是铁,应作阴极,故A错误.
B、船底镶嵌锌块,锌、铁和海水构成原电池,锌作负极,铁作正极,锌被腐蚀从而保护了铁,故B正确.
C、钢铁的吸氧腐蚀中,正极上氧气得电子发生还原反应和水生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故C正确.
D、工业上电解饱和食盐水时,氯离子的放电能力大于氢氧根离子,所以阳极上氯离子失电子生成氯气,电极反应式为:2Cl--2e-=Cl2↑,故D正确.
故选A.
本题解析:
本题难度:简单