1、选择题 下列除去物质杂质所选试剂或方法不正确的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:A.二氧化碳与NaOH溶液反应生成碳酸钠和水;
B.杂质CuSO4与铁粉反应生成铜和硫酸亚铁;
C.氧化钙能与水发生反应生成氢氧化钙;
D.盐酸与碳酸钾反应生成氯化钾、二氧化碳和水.
解答:A.杂质二氧化碳与NaOH溶液反应生成碳酸钠和水,故A正确;
B.杂质CuSO4与铁粉反应生成铜和硫酸亚铁,过滤即可,故B正确;
C.氧化钙可与水反应生成难挥发的氢氧化钙,乙醇和氧化钙不反应,所以可用加生石灰蒸馏的方法分离,故C错误;
D.因盐酸与碳酸钾反应生成氯化钾、二氧化碳和水,二氧化碳是气体会从溶液中逸出,则不会引入杂质,得到氯化钾的溶液,再蒸发、结晶可得到氯化钾,故D正确.
故选C.
点评:本题主要主要考查了物质的除杂,题目难度不大,抓住除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质是解题的关键.
本题难度:简单
2、选择题 下列推断或表述正确的是
A.分别将体积各为1L的1mol/L NaCI溶液和1mol/L的NaF溶液加水稀释至100L,两溶液离子总数相等
B.将pH =a的醋酸溶液稀释100倍,稀释液pH=b,则b=a+2
C.0.2mol/L的盐酸与0.05mol/L的Ba( OH)2溶液等体积混合,混合液pH =1
D.向1L,0.3mol/L的NaOH溶液缓缓通入CO2气体,至溶液质量增加8.8g,则溶液中:2c(Na+)?3[c(HCO3-)+c(CO32-)+c(H2CO3)]
参考答案:D
本题解析:试题分析:A、NaF是强碱弱酸盐,会发生水解,故错;B、醋酸是弱酸,弱电解质,存在电离平衡,b<a+2,故错;C、最后溶液的浓度为0.05mol/L,故错。故选D。
考点:盐类的水解 电离平衡 pH计算
点评:本题考查的是盐类的水解、电离平衡、pH计算的知识,题目难度中,熟悉各个平衡的原理是解题的关键。
本题难度:困难
3、选择题 下列各组物质,都能使溴水褪色的是
A.苯酚溶液、氨水、氯水
B.AgNO3溶液、KBr溶液、K2SO4溶液
C.苯乙烯、己烯、电石气
D.KI溶液、H2S溶液、NaOH溶液
参考答案:C
本题解析:
本题难度:困难
4、填空题 (10分)海藻中含有丰富的、以离子形式存在的碘元素.如图是实验室从海藻里提取碘的流程的一部分。
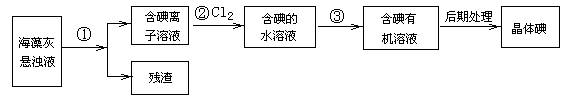
回答下列问题:
(1)步骤①、③的操作分别是 。
(2)步骤②的离子反应方程式: 。步骤②中Cl2应 (填少量或适量或过量)。
(3)在步骤②中若不用Cl2,则下列氧化剂中最好选用(填代号): 。
A.浓硫酸
B.新制氯水
C.高锰酸钾溶液
D.双氧水