1、选择题 在物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa混合溶液中,测得c(CH3COO-)>c(Na+)则下列关系式正确的是( )
A.c(H+)>c(OH-)
B.c(OH-)>c(H+)
C.c(CH3COOH)>c(CH3COO-)
D.c(CH3COOH)+c(CH3COO-)=0.02mol/L
参考答案:A.物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa混合溶液中,测得c(CH3COO-)>c(Na+),由电荷守恒可知c(OH-)+c(CH3COO-)=c(H+)+c(Na+),则c(OH-)<c(H+),故A正确;
B.由A的分析可知,c(OH-)<c(H+),故B错误;
C.醋酸的电离程度大于醋酸根离子的水解,则c(CH3COOH)<c(CH3COO-),故C错误;
D.物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa混合溶液,由物料守恒可知,c(CH3COOH)+c(CH3COO-)=0.02mol/L,故D正确;
故选AD.
本题解析:
本题难度:简单
2、选择题 某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。据图判断错误的是

A.a的数值一定大于9
B.I为氢氧化钠溶液稀释时溶液的pH变化曲线
C.完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V( NaOH)<V(氨水)
D.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
参考答案:D
本题解析:根据题意知,一水合氨为弱电解质,氢氧化钠为强电解质,pH相同的氨水和氢氧化钠溶液,氨水的物质的量浓度大于氢氧化钠溶液;加水稀释相同的倍数,一水合氨的电离平衡正向移动,溶液的pH变化较小。B、根据题给图像可知,开始二者pH相同,在稀释过程中促进氨水的电离,则氨水的pH变化较小,即I为氢氧化钠溶液稀释时溶液的pH变化曲线,正确;C、根据题给图像可知,开始二者pH相同,一水合氨为弱电解质,氢氧化钠为强电解质,pH相同的氨水和氢氧化钠溶液,氨水的物质的量浓度大于氢氧化钠溶液;加水稀释相同的倍数,氨水的物质的量浓度仍较大,完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V( NaOH)<V(氨水),正确;D、碱溶液分析水的电离即判断溶液中氢离子浓度大小,稀释后氨水的pH大于NaOH溶液的pH,稀释后氨水中水的电离程度比NaOH溶液中水的电离程度小,错误。
本题难度:一般
3、选择题 醋酸是电解质,下列事实都能说明醋酸是弱电解质的组合是(?)
①醋酸与水能以任意比互溶?②醋酸溶液能导电
③醋酸溶液中存在醋酸分子?④0.1 mol/L醋酸的pH比0.1 mol/L盐酸pH大
⑤醋酸能和碳酸钙反应放出CO2?⑥常温下0.1 mol/L醋酸钠溶液pH=8.9
⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
A.②⑥⑦
B.③④⑤⑥
C.③④⑥⑦
D.①②
参考答案:C
本题解析:①醋酸与水能以任意比互溶,不能说明醋酸存在电离平衡,所以不能证明醋酸是弱酸,故错误;②醋酸溶液能导电,只能说明醋酸能电离,不能说明醋酸的电离程度,所以不能证明醋酸是弱酸,故错误;③醋酸稀溶液中存在醋酸分子,说明醋酸存在电离平衡,能证明醋酸是弱酸,故正确;④常温下,0.1mol/L醋酸的pH比0.1mol/L盐酸的pH大,说明醋酸不完全电离,能证明醋酸是弱酸,故正确;⑤醋酸能和碳酸钙反应放出CO2,说明醋酸酸性比碳酸强,但不能说明醋酸的电离程度,所以不能证明醋酸是弱酸,故错误;⑥0.1mol/L醋酸钠溶液pH=8.9,其水溶液呈碱性,说明醋酸是强碱弱酸盐,所以能说明醋酸是弱酸,故正确;⑦大小相同的锌粒与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢,说明醋酸中氢离子浓度小于盐酸中氢离子浓度,则证明醋酸是弱酸,故正确.
本题难度:一般
4、选择题 25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: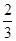 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):