1、选择题 常温下,有甲、乙两份体积均为1 L,浓度均为 0.1 mol/L 的氨水,其pH为11。
①甲用蒸馏水稀释至1/100后,溶液的pH变为a;
②乙与等体积、浓度为 0.2 mol/L 的盐酸混合,在混合液中n(NH4+)+n(H+)-n(OH-)= b mol。
则关于a、b值的正确答案组合是
[? ]
A.9~11;0.1
B.9~11;0.2
C.12~13;0.2
D.13;0.1
参考答案:B
本题解析:
本题难度:一般
2、选择题 常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是
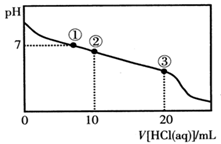
A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)
参考答案:C
本题解析:A.点①所示溶液中pH=7,则:c(H+)=c(OH-);根据物料守恒可得c(Na+)=c(Cl-)+c(CH3COO-).盐的电离远大于弱电解质水的电离,因此微粒关系是c(Na+)=c(Cl-)+c(CH3COO-)>c(H+)=c(OH-)。错误。B.点②所示溶液中,由于发生反应:CH3COONa+HCl= CH3COOH+NaCl.由于二者是以2:1物质的量关系混合的,所以反应后的溶液为CH3COONa、CH3COOH、NaCl按照1:1:1的物质的量关系混合。由于CH3COOH的电离作用大于CH3COO-的水解作用,所以c(CH3COO-) >c(CH3COOH), c(CH3COO-) > c(Cl-);根据物料守恒可得c(Na+) >c(CH3COO-)。因此微粒的关系为c(Na+)>c(CH3COO-) >c(Cl-)>c(CH3COOH)。错误。C.点③所示溶液中恰好发生反应CH3COONa+HCl= CH3COOH+NaCl。得到的溶液为CH3COOH和NaCl的混合溶液。由于CH3COOH要发生电离作用,所以c(Na+)>c(CH3COOH);在溶液中除了醋酸电离产生H+外,还存在水的电离平衡,因此c(H+)>c(CH3COO-);但是醋酸是弱酸,电离程度是微弱的,因此c(CH3COOH)>c(H+)。故微粒关系为: c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)。正确。D.根据物料守恒可得: c(Na+)=c(CH3COO-)+c(CH3COOH)。因此比可能出现c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)。错误。
本题难度:一般
3、选择题 已知,25℃时有关弱酸的电离平衡常数如下:
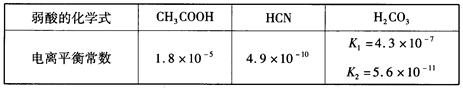
则下列有关说法正确的是( )
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大于a
C.向冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.等物质的量NaHCO3和Na2CO3的混合溶液中,一定存在: c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)