1、选择题 短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。则下列有关说法中正确的是
A.X的氢化物溶于水显酸性
B.Z的氧化物的水化物一定是强酸
C.Y的氧化物是离子化合物
D.X和Z的最高价氧化物对应的水化物都是弱酸
参考答案:C
本题解析:X与Y、Z位于相邻周期,短周期元素X、Y、Z的原子序数依次递增,则X可能为第二周期的元素,即Y、Z位于第三周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍,则Z的最外层电子数为2×3=6,即Z为硫,Y的最外层电子数为 6/3=2,即为镁元素,再由原子的最外层电子数之和为13,则X的最外层电子数为13-2-6=5,即X为氮元素;
A、利用氨气与水反应即氨水的电离来分析;
B、利用氧化镁的构成微粒来分析;
C、利用硫化氢中硫元素的化合价来分析其性质;
D、X的最高价氧化物对应的水化物为硝酸,Z的最高价氧化物对应的水化物为硫酸故选c
本题难度:一般
2、推断题 有关元素X、Y、Z、W的信息如下

请回答下列问题:
(1)Y的单质在空气中充分燃烧所得氧化物的电子式为____________
(2)X、Y、W的简单离子的半径由大到小的顺序是_________(写离子符号)
(3)向淀粉碘化钾溶液中滴加几滴ZX3的浓溶液,现象为________________________,基态Z3+的电子排布式为___________
(4)以WX3溶液为原料制取无水WX3,主要操作包括加热浓缩、冷却结晶、过滤,先制得WX3·6H2O晶体,然后在________条件下加热WX3·6H2O晶体,能进一步制取无水WX3,其原因是(结合离子方程式简要说明)___________________。
参考答案:(1) (2)Cl->Na+>Al3+
(2)Cl->Na+>Al3+
(3)溶液变为蓝色;1s22s22p63s23p63d5
(4)干燥的HCl气流;Al3++3H2O Al(OH)3+3H+,在干燥的HCl气流中,可抑制AlCl3的水解,且带走
Al(OH)3+3H+,在干燥的HCl气流中,可抑制AlCl3的水解,且带走
AlCl3·6H2O晶体受热产生的水蒸气
本题解析:
本题难度:一般
3、简答题 针对下面10种元素,完成以下各小题.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
C
N
O
Ne
3
Na
Mg
Al
Si
S
Cl
|
(1)地壳中含量最多的元素是______(填名称).
(2)化学性质最不活泼的元素是______(填元素符号).
(3)Al的原子结构示意图为______.
(4)C与N相比,原子半径较小的是______.
(5)最高价氧化物对应的水化物碱性最强的是______(填化学式).
(6)MgO和Al2O3中,属于两性氧化物的是______.
(7)S和Cl相比,元素非金属性较强的是______.
(8)可用来制造光导纤维的物质是______,晶体硅的主要用途是______(写出一种).
参考答案:(1)地壳中含量最多的元素是氧;
故答案为:氧;
(2)Ne为零族元素,最外层电子数为8,处于稳定结构,化学性质最不活泼;
故答案为:Ne;
(3)铝原子核外电子数为13,有3个电子层,最外层电子数为3,原子结构示意图为: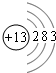 ;
;
故答案为: ;
;
(4)同周期随原子序数的增大,核电荷数对核外电子引力增大,原子半径减小,故原子半径C>N;
故答案为:N;
(5)根同周期自左而右金属性减弱,同主族自上而下金属性增强,金属性最强的元素处于周期表的左下角,Na元素的金属性最强,故NaOH碱性最强;
故答案为:NaOH;
(6)MgO与酸反应生成盐与水,不与碱反应,不属于两性氧化物,Al2O3能与酸或碱反应生成盐与水,属于两性氧化物;
故答案为:Al2O3;
(7)同周期自左而右元素的非金属性增强,故非金属S<Cl;
故答案为:Cl;
(8)制造光导纤维的物质是二氧化硅,晶体硅的主要用途是作半导体材料制作芯片或制造光电池等;
故答案为:二氧化硅,做半导体材料制作芯片或制造光电池.
本题解析:
本题难度:简单
4、推断题 A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写元素符号:A为_________,B为_________,C为_________。D的最高价氧化物的水化物化学式是
_________。
(2)写出A、B形成的化合物与E反应的化学方程式:___________________________。
(3)E属_________(“离子”或“共价”)化合物。E中含_________键.
(4)C与D两元素可形成化合物,用电子式表示其化合物的形成过程___________________________。
参考答案:(1)C;O;Na;H2SO4
(2)2CO2+2Na2O2==2Na2CO3+O2↑
(3)离子;离子键、共价键
(4)
本题解析:
本题难度:一般
5、选择题 下列关于碱金属及其化合物的叙述正确的是( )
A.熔沸点从锂到铯逐渐降低
B.随核外电子层数递增,单质密度 91eXAm.org依次增大
C.Li在氧气中燃烧生成Li2O2
D.碳酸铯受热易分解
参考答案:A.从锂到铯原子半径逐渐增大,金属键逐渐减弱,沸点熔沸点逐渐降低,故A正确;
B.随核外电子层数递增,单质的谜底呈增大的趋势,但K的密度比Na小,故B错误;
C.Li与Mg的性质相似,在氧气中燃烧生成Li2O,故C错误;
D.金属性越强的金属,其碳酸盐越难以分解,铯的金属性最强,碳酸铯加热不分解,故D错误.
故选A.
本题解析:
本题难度:简单