|
高中化学知识点大全《反应速率与平衡的有关计算》考点强化练习(2017年押题版)(四)
2017-11-11 02:30:29
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 (17分)氨的合成原理为:N2(g)+3H2(g) 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
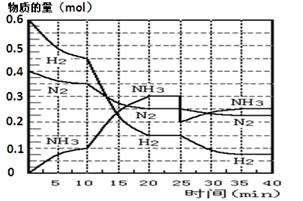
回答下列问题:
(1)10 min内以NH3表示的平均反应速率?;
(2)在10 ~20 min内:NH3浓度变化的原因可能是?;
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
| (3)第1次平衡的时间范围为:?,第2次平衡的时间范围为:?,
第1次平衡:平衡常数K1 = ?(带数据的表达式),第2次平衡时NH3的体积分数?;
(4)在反应进行至25 min时:
①曲线发生变化的原因:??
②达第二次平衡时,新平衡的平衡常数K2??K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= ?。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) ?2NH3(g) + ?2NH3(g) +  O2(g)?;△H =" a" kJ·mol—1 O2(g)?;△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
T/K
| 303
| 313
| 323
| NH3生成量/(10-6mol)
| 4.8
| 5.9
| 6.0
|
①此合成反应的a?0;ΔS?0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g)? ΔH= -92 .4kJ·mol—1 2NH3(g)? ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:?
参考答案:(17分)(1)v = 0.005 mol·L-1 ·min-1?;(1分)?(2)AB(1分)
(3)20~25 min?(1分)? 35~40 min?(1分)
K =(0.15)2 0.125×(0.075)3?(带数据的表达式),(1分) 45.5 %?;(1分)
(4)①移走0.1 mol NH3,(2分)②等于(1分)
(5)△H= —2.31 KJ·mol-1。(2分)?(6)?①>、>?(各1分)
②2N2(g) + 6H2O(1) = 4NH3(g) + 3O2(g) ΔH="+1530" kJ·mol-1 (2分)或
N2(g) + 3H2O(1) = 2NH3(g) +  O2(g) ΔH="+765" kJ·mol-1 (2分) O2(g) ΔH="+765" kJ·mol-1 (2分)
本题解析:(1)根据图像可知,10min时氨气的物质的量是0.1mol,浓度是0.05mol/L,所以其反应速率是0.05mol/L÷10min= 0.005 mol·L-1 ·min-1。
(2)根据图像可知,在10 ~20 min内氨气的生成速率增大,再20min时反应达到平衡状态,所以改变的条件应该是使用了催化剂会缩小了容器容积,答案选AB。
(3)反应进行到25min是物质的浓度又方式变化,所以第1次平衡的时间范围为20~25 min;同样根据图像可知,第2次平衡的时间范围为35~40 min;第1次平衡时氨气、氮气和氢气的浓度分别是(mol/L)0.15、0.125和0.075,所以K =(0.15)2 0.125×(0.075)3;第2次平衡时氨气、氮气和氢气的物质的量分别是(mol)0.25、0.225、0.075,所以氨气的体积分数是 。 。
(4)①根据图像可知,25min是氨气的物质的量降低到0.2mol,而氮气和氢气的物质的量逐渐减小,所以改变的条件是移走0.1 mol NH3。
②温度不变,所以平衡常数是不变的。
(5)感觉图像可知,在25~40 min时,又生成0.05mol氨气,所以放出的热量是0.05mol×92.4kJ/mol÷2=2.31kJ。
(6)①根据表中数据可知,随着温度的升高,氨气的物质的量逐渐增加,说明升高温度,平衡向正反应方向移动,因此正反应是吸热反应;根据方程式可知,气体的分子数增加,所以熵值是增加的。
②根据盖斯定律可知,该反应的热化学方程式是2N2(g) + 6H2O(1) = 4NH3(g) + 3O2(g),所以反应热△H=-92 .4kJ·mol—1×2+3×571.6kJ·mol—1=+1530 kJ·mol-1。
本题难度:一般
2、填空题 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示: CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃
| 700
| 800
| 830
| 1 000
| 1 200
| K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
?
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。?
(2)该反应为 反应(填“吸热”或“放热”)。?
(3)能判断该反应是否达到化学平衡状态的依据是( )
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。?
参考答案:(1)? (2)吸热 (3) BC (4)830
本题解析:(1)根据化学平衡常数的定义式即可写出
(2)由表中数据可以看出温度越高,平衡常数越大,说明反应混合物中CO或水蒸气的浓度越大,即升温,平衡向右移动,正反应为吸热反应。
(3)该反应为物质的量不变的反应,反应过程中压强始终不变,与平衡与否无关。
(4)当c(CO2)·c(H2)=c(CO)·c(H2O)时,K=1,此时的温度由表中数据可知为830 ℃。
本题难度:一般
3、选择题 一密闭体系中发生反应:2SO2(g)+O2(g) 2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是 2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
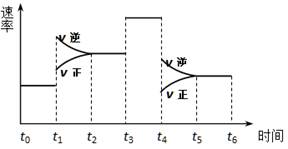
A.t0→t1
B.t2→t3
C.t3→t4
D.t5→t6
参考答案:A
本题解析:观察图中所示,B、C项:化学平衡逆向移动,SO3的百分含量减少,故错。故选A。
点评:本题考查的是化学平衡的移动的相关知识,题目难度不大,学习中注意相关基础知识的积累,此类题目可轻松解答。
本题难度:简单
4、选择题 已知反应A+3B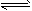 2C+D在某段时间内以A的浓度变化表示的化学反应速度为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为 2C+D在某段时间内以A的浓度变化表示的化学反应速度为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
[? ]
A.0.5mol·L-1·min-1
B.1 mol·L-1·min-1
C.2 mol·L-1·min-1
D.3 mol·L-1·min-1
参考答案:C
本题解析:
本题难度:简单
5、选择题 在一定温度下,向a L密闭容器中加入1 mol X和2mol Y,发生如下反应:
X(s) + 2Y(g)?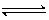 2Z(g)?此反应达到平衡的标志是 2Z(g)?此反应达到平衡的标志是
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为l : 2 : 2
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
参考答案:B
本题解析:A错,该反应为等体积反应,无论平衡与否体系内压强均不变;B正确,达平衡时各组分的浓度不再发生改变;C错,平衡时各组分的浓度比不一定为化学计量数之比;D错,每时每刻均这样反应;
本题难度:一般
|  ?2NH3(g) +
?2NH3(g) +  O2(g)?;△H =" a" kJ·mol—1
O2(g)?;△H =" a" kJ·mol—1 2NH3(g)? ΔH= -92 .4kJ·mol—1
2NH3(g)? ΔH= -92 .4kJ·mol—1