1、选择题 一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是?
2Z(g)一定达到化学平衡状态的是?
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①②
B.①④
C.②③
D.③④
参考答案:C
本题解析:X、Y、Z的物质的量之比等于其化学计量数之比,不能作为平衡的标志,①错;X、Y、Z的浓度保持不变可以作为平衡的标志,②对;该反应为反应前后气体分子数不相等的反应,密闭容器中压强保持不变可以作为平衡的标志,③对;单位时间内生成n mol Z的同时生成n mol Y时正逆反应速率相等,④错。
本题难度:一般
2、选择题 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在一恒温恒压的密闭容器里充入2mol?N2和8mol?H2达到平衡时生成1mol?NH3.现在相同条件下的同一容器中充入xmol?N2,ymol?H2和2mol?NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ.则x、y的值为( )
A.1.5,6.5
B.2,8
C.5,21
D.3,13
参考答案:N2(g)+3H2(g)?2NH3(g)
开始2? 8? 0
转化0.5?1.5? 1
平衡1.5? ?6.5?1
氮气的转化率为0.5mol2mol×100%=25%,放出热量为46.2kJ;
相同条件下的同一容器中充入xmol?N2,ymol?H2和2mol?NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ,
则二者为等效平衡,所以
? ?N2(g)+3H2(g)?2NH3(g)
开始x?y? 2
等效x+1? y+3
则x+1y+3=2mol8mol=14,
解得4x+1=y,
A.4×1.5+1≠6.5,故A错误;
B.4×2+1≠8,故B错误;
C.5×4+1=21,由放出的热量设氮气转化nmol,则92.4n-92.4=46.2,所以n=1.5mol,氮气的转化率为25%,故C正确;
D.3×4+1=13,由放出的热量设氮气转化nmol,则92.4n-92.4=46.2,所以n=1.5mol,氮气的转化率为37.5%,故D错误;
故选C.
本题解析:
本题难度:一般
3、填空题 (12分)随着氮氧化物污染的日趋严重,我国将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法:
(1)用活性炭还原法处理氮氧化物。有关反应为:C(g)+2NO(g)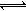 N2(g)+CO2(g)?△H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
N2(g)+CO2(g)?△H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
?浓度/mol?L-1
时间/min
| NO
| N2
| CO2
|
0
| 0.100
| 0
| 0
|
10
| 0.058
| 0.021
| 0.021
|
20
| 0.040
| 0.030
| 0.030
|
30
| 0.040
| 0.030
| 0.030
|
40
| 0.032
| 0.034
| 0.017
|
50
| 0.032
| 0.034
| 0.017
|
①T1℃时,该反应的平衡常数K=?(保留两位小数)
②30min后,改变某一条件,经过一段时间后反应重新达到平衡,则改变的条件可能是?
③若30min后升高温度至T2℃,达到平衡时,容器 中的NO、N2、CO2的浓度之比为5:3:3,则该反应的△H?(填“>”、“<”或“=”)0
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H20(g)?△H=-574kJ.mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?△H=-1160kJ.mol-1
③H2O(g)=H2O(l)?△H=-44.0kJ.mol-1
写出CH4和NO2反应生成N2(g) 、CO2(g)和 H2O(l)的热化学方程式:?
?
(3)选择性催化还原(SCR)脱硝技术是目前应用最广、最有效的烟气脱硝技术之一。该技术涉及以下反应:4NO(g)+4NH3(g)+ O2(g)=在4N2(g)+ 6H2O(g),在恒容的密闭容器中,下列有关说法中正确的是?(填字母)
A.其他条件不变,使用高效催化剂,烟气中NO的转化率增大
B.单位时间内消耗NH3和NO的物质的量之比为1:1时,反应达到平衡
C.其他条件不变时升高温度,反应的平衡常数减小
D.反应达到平衡后,再向容器中充入等量的反应物,再次达到平衡时,NO的转化率减小
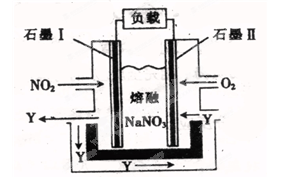
(4)以NO2 、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,该电极的电极反应可表示为?
参考答案:(1)①0.56?②减少CO2的浓度(其他合理答案均可)③<
(2)CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(l)?△H=-955kJ.mol-1
(3)CD? (4)NO2+NO3—-e-=N2O5
本题解析:(1)①根据表中数据可知,平衡常数为 。
。
②根据数据变化可知,NO浓度减小,氮气浓度增加,CO2浓度减小,说明平衡向正反应方向移动,所以改变的体积是减小CO2的浓度。
③原容器中的NO、N2、CO2的浓度之比为4:3:3,这说明升高温度平衡向逆反应方向移动,因此正反应是放热反应。
(2)考查盖斯定律的应用,(①+②+③×4)÷2即得到
CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(l),所以反应热是
(―574kJ.mol-1―1160kJ.mol-1―-44.0kJ.mol-1×4)÷2=-955kJ.mol-1。
(3)(3)催化剂不能改变平衡状态,A不正确。选项B中反应速率的反应相同,始终成立,B不正确。正反应是放热反应,所以升高温度平衡向逆反应方向移动,平衡常数减小,C正确。该反应是体积增大的可逆反应,选项D相当于增大压强,所以平衡向逆反应方向移动,转化率降低,D正确,答案选CD。
(4)根据装置图可知石墨Ⅱ通入氧气,是正极,所以石墨I是负极,失去电子,反应式为NO2+NO3—-e-=N2O5。
本题难度:一般
4、填空题 (8分)可逆反应 A(g) + 2B(g)  ?2C(g)? ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
?2C(g)? ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
(1) 升高温度,B的转化率?,v(正)?,v(逆)?。
(2) 保持温度和压强不变,加入惰性气体,则C的物质的量?,A的转化率?。
(3) 保持温度和体积不变,加入惰性气体,A的转化率?。
(4) 若温度和体积不变,反应从开始到平衡,容器内气体的密度?,压强?。
参考答案:(1)减小;增大;增大(2)减小;减小(3)不变(4)不变;减小
本题解析:(1)正反应是放热反应,所以升高温度,正逆反应速率都增大,但平衡向逆反应方向进行,B的转化率降低。
(2)保持温度和压强不变,加入惰性气体,则容器容积增大,所以平衡逆反应方向进行,C的物质的量和A的转化率都是减小的。
(3)保持温度和体积不变,加入惰性气体,物质的浓度不变,平衡不移动,A的转化率不变。
(4)密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以容器内气体的密度不变,但压强是减小的。
本题难度:一般
5、选择题 某密闭容器中充入一定量SO2、O2,发生反应2SO2+O2 2SO3,测得SO3浓度与反应温度关系如图。下列说法正确的是? (? )
2SO3,测得SO3浓度与反应温度关系如图。下列说法正确的是? (? )

A.该反应AH>0
B.SO2转化率:a>b>c
C.化学反应速率:c>b>a
D.平衡常数K:b>c>a
参考答案:C
本题解析:A、图像上b点以后都处于平衡状态,升高温度SO3的浓度降低,说明平衡向逆反应移动,故正反应为放热反应,?H<0,错误;B、三氧化硫的浓度越大,二氧化硫的转化率越高,故二氧化硫转化率b>c>a,错误; C、温度越高反应速率越快,故化学反应速率:c>b>a,正确;D、该反应正反应是放热反应,温度升高,平衡向逆反应移动,故温度越高,平衡常数越小,平衡常数K:a>b>c,错误。
本题难度:一般