1、选择题 下列说法中正确的是( ? )
A.二氧化硫的排放会造成温室效应
B.绿色食品是不含任何化学物质的食品
C.Cu和浓H2SO4反应,H2SO4即表现氧化性,又表现酸性
D.用加热的方法不能鉴别NaHCO3和Na2CO3固体
参考答案:C
本题解析:
本题难度:一般
2、选择题 2010年4月14日持续喷发的冰岛火山产生的火山灰(主要含有二氧化硫、氢氟酸和许多矿物质)给世界航空业带来了巨大的经济损失。下列有关硫及其化合物的说法中正确的是
[? ]
A.火山喷发产生的火山灰中不可能含有SO3气体
B.等物质的量的SO2与Cl2同时通入水中,所得溶液的漂白性增强、pH减小
C.相同质量的SO2和SO3中分子数之比为1:1
D.一定条件下,将铁粉放入SO3和水反应的溶液中,可以得到两种气体
参考答案:D
本题解析:
本题难度:简单
3、简答题 国家环保总局“环境监测公报”指出,减少SO2的排放和生活废水的处理是
我国“十一五”期间环境保护的主要任务.请回答下列问题:
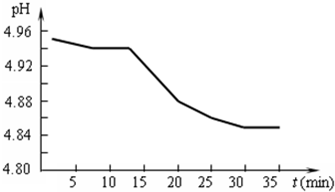
(1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因______.
(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应回收SO2,该技术较传统用NaOH溶液吸收及用H2SO4回收SO2处理方法的优点是______.
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+
Sx、CO+Sx=COS、2COS+SO2=2CO2+Sx.其中COS(羰基硫)分子的电子式为______.
(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀.请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为______.若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后在该酸性溶液中加入甲醇,NO3-和甲醇转化为两种无毒气体.请写出加入甲醇后反应的离子方程式______.
参考答案:(1)某地区酸雨pH随时间的变化分析,随时间增长,溶液PH减小,证明氢离子浓度增大,酸雨形成是二氧化硫溶于水生成亚硫酸,亚硫酸钡氧气氧化为硫酸,从弱酸变化为强酸,溶液中氢离子浓度增大,PH减小,反应的化学方程式为:2H2SO3+O2=2H2SO4;故答案为:2H2SO3+O2=2H2SO4;
(2)采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,可作为肥料,减低污染,达到充分利用资源的目的,变废为肥,充分利用资源,降低污染;
故答案为:既能回收利用SO2,又能得到复合肥磷铵;
(3)C的非金属性小于O和S,结构式为O=C=S,C的化合价为+4价,结合原子结构写出电子式为:

;
故答案为:

;
(4)氢氧化铝、氢氧化铁形成的胶体具有较大表面积能吸附悬浮杂质的作用,常见的能使生活污水中悬浮物聚沉的物质有明矾、绿矾高铁酸盐等;消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后在该酸性溶液是硝酸溶液,具有强氧化性,加入甲醇,硝酸根离子和氢离子能氧化甲醇为无毒气体为二氧化碳,NO3-和甲醇转化为两种无毒气体,推断硝酸钡还原为氮气,反应的离子方程式为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
故答案为:KAl(SO4)2?12H2O或?FeSO4?7H2O;? 6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
本题解析:
本题难度:一般
4、选择题 酸雨是指pH为多少的雨水( )
A.pH<5.6
B.pH>5.6
C.7<pH<5.6
D.pH=7
参考答案:A
本题解析:
本题难度:简单
5、简答题 形成酸雨的原理之一可表示如下:

试回答下列问题:
(1)图中三个反应不属于氧化还原反应的是______(填标号).
(2)从保护环境的角度出发,工业上正努力从酸雨产生的根源出发进行治理,以减小酸雨的污染.方法一是将SO2中+4价硫元素变成0价硫元素,利用这一原理,可在工厂的烟道气中通入合适的______(填“氧化剂”或“还原剂”)除去SO2;方法二是一些工厂用过量的氨水(NH3?H2O)吸收SO2,此化学反应的产物是______.
(3)火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO等,为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为硫酸钙等.写出用CaCO3悬浊液洗涤上述废气的化学方程式:______.
参考答案:(1)含硫物质燃烧生成二氧化硫是氧化还原反应,二氧化硫被氧化为三氧化硫是氧化还原反应,三氧化硫溶于水生成硫酸是化合反应,反应过程中无元素化合价变化,是非氧化还原反应;
故答案为:③;
(2)减小酸雨的污染.方法一是将SO2中+4价硫元素变成0价硫元素,利用这一原理是利用二氧化硫的氧化性,可以通入还原剂还原二氧化硫除去二氧化硫;用过量的氨水(NH3?H2O)吸收SO2,二氧化硫是酸性氧化物和碱反应生成盐和水,氨水过量反应生成亚硫酸铵和水;
故答案为:还原剂,亚硫酸铵、水;
(3)废气中往往含有SO2、O2、N2、CO等,为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为硫酸钙等,利用氧气氧化二氧化硫生成三氧化硫,和碳酸钙反应生成硫酸钙和二氧化碳写出,发生的反应为:2SO2+O2+2CaCO3═2CaSO4+2CO2;
故答案为:2SO2+O2+2CaCO3═2CaSO4+2CO2;
本题解析:
本题难度:一般