1、简答题 (附加题)工业上根据污水中所含物质或离子的不同,有多种处理方法,比如:
| 污水中所含离子 | 处理方法
H+或OH-
中和法
Cu2+、Hg2+
沉淀法
CN-
氧化还原法
|
请回答:
(1)在中和法中,若用CO2来处理污水,则离子方程式是______.
(2)在沉淀法中,用硫化钠作沉淀剂,能有效地处理含Cu2+、Hg2+等重金属离子的污水.若某污水中能与硫化钠反应的阳离子只有Hg2+,且含量为400mg/L,则处理10L这样的污水至少需要加入硫化钠______g(精确到0.1).
我国规定Hg2+的排放标准不能超过0.05mg/L,若1L污水经过沉淀法处理后含Hg2+为2×10-7mol,则该污水是否达到了排放标准______(填“是”或“否”).
(3)在氧化还原法中,常用Cl2氧化污水中的有毒物质CN-,可得到无毒无害的CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式是______.
参考答案:(1)利用中和法处理污水,反应后溶液基本呈中性,产物中应存在大量的NaHCO3,而Na2CO3溶液呈碱性,则不可能为Na2CO3,所以反应的离子方程式应为CO2+OH-═HCO3-,如写成CO2+2OH-═CO32-+H2O,则不符合题意要求,
故答案为:CO2+OH-═HCO3-(写成CO2+2OH-═CO32-+H2O不给分);
(2)10L这样的污水中含有Hg2+的质量为10L×400mg/L=4000mg,即4g,物质的量为n(Hg2+)=4g200g/mol=0.02mol,
反应的离子方程式为Hg2++S2-=HgS,则n(Na2S)=n(S2-)=n(Hg2+)=0.02mol,
质量为:0.02mol×78g/mol=1.56g≈1.6g,
若1L污水经过沉淀法处理后含Hg2+为2×10-7mol,则1L污水含Hg2+质量为:2×10-7mol×200g/mol=4×10-5g,
即0.04mg<0.05mg,则该污水达到了排放标准,
故答案为:1.6;是;
(3)由题意知反应物为Cl2和CN-,生成物为CO2和N2,且参加反应的Cl2与CN-的物质的量之比为5:2,根据质量守恒定律可知,反应物中还应有H2O,则反应的离子方程式为
5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+,故答案为:5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+.
本题解析:
本题难度:简单
2、选择题 下列离子方程式书写不正确的是( )
A.用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O
B.碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-=NH3↑+H2O
C.用氯酸钠的酸性溶液与H2O2作用制取ClO2:4ClO3-+4H2O2+4H+=4ClO2↑+3O2↑+6H2O
D.用硫酸酸化的桔红色的重铬酸钾(K2?Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O
参考答案:A.用醋酸溶解碳酸钙的离子反应为2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O,故A正确;
B.碳酸氢铵溶液中加入足量热的氢氧化钠溶液的离子反应为HCO3-+NH4++2OH-=NH3↑+2H2O+CO32-,故B错误;
C.用氯酸钠的酸性溶液与H2O2作用制取ClO2的离子反应为2ClO3-+H2O2+2H+=2ClO2↑+O2↑+2H2O,故C错误;
D.检测是否酒后驾驶的离子反应为2Cr2O72-+3C2H5OH+16H+=4Cr3++3CH3COOH+11H2O,故D正确;
故选BC.
本题解析:
本题难度:一般
3、选择题 下列离子反应中,表达正确的是
[? ]
A.向AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
B.用醋酸溶解CaCO3:CaCO3+2H+=Ca2++CO2↑+H2O
C.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
D.向Mg(HCO3)2溶液中加入过量澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
参考答案:AC
本题解析:
本题难度:一般
4、选择题 下列化学反应的离子方程式正确的是
A.次氯酸钠漂液中加浓盐酸产生氯气:ClO- + Cl-+2H+=Cl2↑+H2O
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3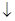 +2HClO
+2HClO
C.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S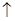
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO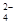 =CaSO4
=CaSO4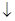 +H2O
+H2O
参考答案:A
本题解析:A正确;B错,CaSO3具有还原性能被HCLO氧化成硫酸钙;C错,硝酸具有强氧化性能氧化FeS固体;D错,正确为:Ca2++2OH-+2H++SO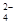 =CaSO4
=CaSO4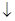 +2H2O;
+2H2O;
本题难度:一般
5、选择题 下表中评价合理的是:
选项
| 化学反应及其离子 方程式 方程式
| 评?价
|
A
| NaHSO4溶液与Ba(OH)2溶液反应至中性:
2H++SO42-+Ba2++2OH- = BaSO4↓ + 2H2O
| 正确
|
B
| 向碳酸镁溶液中加入足量稀盐酸:
CO32-+2H+=CO2↑+H2O
| 错误,碳酸镁不应写成离子形式
|
C
| 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:
Fe3++3H2O = Fe(OH)3↓+3H+
| 正确
|
D
| NaOH溶液中通入少量CO2反应:OH-+CO2=HCO3-
| 正确
|
?
参考答案:A
本题解析:略
本题难度:一般