1、选择题 下列离子方程式书写正确的是
A.Cu(OH)2中加入硫酸:OH-+H+=H2O
B.钠加入水中:Na+2H2O=Na++2OH-+H2↑
C.向Ca(HCO3)2溶液加入过量NaOH溶液:2Ca2++2HCO3-+2OH-=2H2O+CO32—+CaCO3↓
D.Al2(SO4)3溶液中加入过量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
2、选择题 下列离子方程式书写正确的是
[? ]
A.硝酸银溶液中滴加过量氨水:?Ag++NH3·H2O==AgOH↓+NH4+
B.碳酸氢铵溶液与足量烧碱溶液共热:NH4++HCO3-+2OH- NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
C.用惰性电极电解硫酸铜溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.金属钠投入水中:Na+2H2O==Na++2OH-+H2↑
3、选择题 下列说法正确的是( )
A.NaHCO3的电离方程式为:NaHCO3=Na++H++CO32-
B.金属氧化物不一定是碱性氧化物
C.在碱性溶液中能大量共存的离子为:Fe3+、Na+、Cl-、SO42-
D.SO3溶于水,其水溶液能导电,SO3是电解质
4、简答题 硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下:
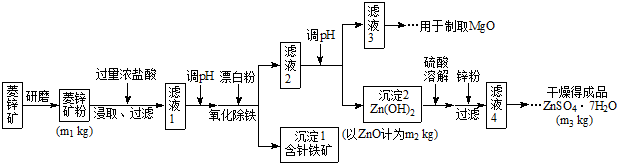
(1)将菱锌矿研磨成粉的目的是______.
(2)完成“氧化除铁”步骤中反应的离子方程式:
______Fe(OH)2+______+______═______Fe(OH)3+______Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是______.
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______.
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3
开始沉淀的pH
10.4
6.4
-
-
沉淀完全的pH
12.4
8.0
-
-
开始溶解的pH
-
10.5
-
-
Ksp
5.6×10-12
-
6.8×10-6
2.8×10-9
|
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号).
a.大理石粉?b.石灰乳?c.纯碱溶液?d.烧碱溶液
(6)“滤液4”之后的操作依次为______、______、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3?的质量分数不低于______.
5、填空题 许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=?;
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2?b.NH4HSO4?c.(NH4)2SO4?d.(NH4)2SO3
其中c(NH4+)由大到小的顺序为??(填选项字母);
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为?;
②样品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g样品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以?为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-= 2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该样品中K2S2O8的质量分数为(杂质不参加反应)?_(结果保留三位有效数字)。