1、实验题 用图所示的装置制取氢气,在塑料隔板上放粗锌粒.漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹。则酸液由漏斗流下,试管中液面上升与锌粒接触,发生反应,产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止。需要时再打开弹簧夹,又可以使氢气发生,这是一种仅适用于室温下随制随停的气体发生装置。
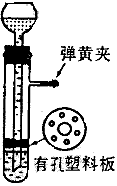
回答下列问题:
(1)为什么关闭弹簧夹时试管中液面会下降?
______________________________________________。
(2)这种制气装置在加入反应物前,怎样检查装置的气密性?
______________________________________________。
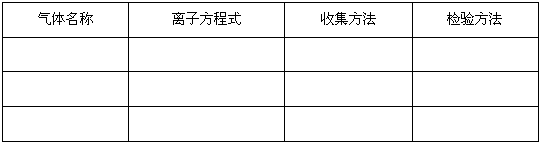
(3)从下面三个反应中选择可以用这种随制随停的制气装置制取的气体,填写下表中的空白。
①大理石与盐酸反应制取CO2
②硫化亚铁与盐酸反应制取硫化氢
③用二氧化锰催化分解过氧化氢制氧气
?(4)食盐跟浓硫酸反应制取氯化氢不能用这种装置,试说明理由。
_________________________________________________
参考答案:(1)关闭弹簧夹,反应产生的气体使试管内液面上的压力增加,所以液面下降。
(2)塞紧橡皮塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,漏斗中与试管中的液面差保持不再变化,说明装置不漏气
(3)
气体名称
离子方程式
收集方法
检验方法
二氧化碳
CaCO3+2H+==Ca2++CO2↑+H2O向上排空气法通入澄清石灰水
硫化氢
FeS+2H+==Fe2++H2S↑ 向上排空气法有臭鸡蛋味(或通入硫酸铜溶液)(4)因为此反应需要加热且食盐是粉末状
本题解析:
本题难度:困难
2、选择题 现有等物质的量的铜和银的混合物17.2克,与50.0mL的浓硝酸恰好完全反应,产生气体4.48L(标准状况),则下列说法正确的是
A.产生的气体是0.2molNO2
B.硝酸的物质的量浓度为12mol/L
C.反应中被还原和未被还原的硝酸物质的量之比为3:2
D.要使产生的气体恰好完全被水吸收需要通入氧气0.075mol
参考答案:D
本题解析:根据题意Cu、Ag的物质的量均为0.1 mol,则反应中共失去电子0.3 mol ,HNO3得电子0.3 mol,若生成0.2molNO2,则HNO3得电子0.2 mol,A错误,未被还原的HNO3为0.1 mol×2+0.1 mol×1="0.3" mol,参加反应的HNO3共0.3 mol+4.48L/22.4Lmol-1 ="0.5" mol ,则硝酸的物质的量浓度为10mol/L,B、C错误,根据D项题意HNO3只起到酸的作用,整个反应可看作Cu、Ag与O2反应,生成的氧化物溶于HNO3,即2Cu~O2 4Ag~O2,D正确。
易错点拨:不能很好的利用计算的技巧而显得茫然、费时。本题可运用得失电子数相等、原子守恒、整体分析法等来解题。
本题难度:简单
3、选择题 将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是(?)
A.M
B.M2+
C.M3+
D.MO2+
参考答案:B
本题解析:n(Zn)= 0.195g ÷65g/mol=0.003mol,Zn是+2价的金属,假设反应后M的化合价为+x价,根据氧化还原反应中电子转移数目相等可知:0.003×2=0.1×0.02(5-x),解得x=+2价,对选项中含M的微粒的化合价进行分析可知:还原产物是M2+,所以选项是B。
本题难度:一般
4、填空题 (9分)硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:

(1)要将洗出液中的溶质析出,采用的方法是 (填:“蒸发”、“降温”)结晶;蒸发时用到的硅酸盐仪器有 、 、 。
(2)上流程中加入NaOH溶液,反应的离子方程式为 。
(3)用上述残渣中的氧化铁焊接铁轨,其铝热反应的化学方程式为(并在方程式中用“单线桥”标出电子转移方向和数目) 。
参考答案:(1)蒸发 蒸发皿、玻璃棒、酒精灯
(2)SiO2 + 2OH— ="=" SiO32— + H2O
(3)
本题解析:石英砂中含有NaCl、Fe2O3等杂质,NaCl能溶于水,而石英砂和Fe2O3不溶于水,所以洗出液中含有NaCl,滤渣中含有Fe2O3和SiO2,研磨滤渣,向滤渣中加入NaOH溶液,发生反应SiO2+2OH-
本题难度:困难
5、选择题 现有含0.1 mol/L的SO32-溶液30 mL,恰好被2×10-3 mol XO4-氧化为SO42-,则元素X在还原产物中的化合价是
A.+4
B.+3
C.+2
D.+1
参考答案:A
本题解析:根据氧化还原反应中得失电子守恒计算。根据题意知,该反应中SO32-为还原剂,SO32-被氧化,为SO42-,化合价从+4升到+6价失电子数=0.1mol/L×0.03L×2=0.006mol,XO4-为氧化剂,X元素化合价降低,设元素X在还原产物中的化合价为n,根据得失电子守恒得2×10-3 mol(7—n)=0.006mol,解得n=4,选A。
本题难度:一般