1、选择题 锌钡白是一种白色颜料,其主要成分是难溶于水的锌盐和钡盐,它们是?
A.ZnCO3和BaCl2
B.ZnCl2和BaCO3
C.ZnS和BaSO4
D.ZnCO3和Ba(NO3)2
参考答案:C
本题解析:根据内容要求,凭对所学化学知识的记忆能力,直接找出答案。A中BaCl2,B中ZnCl2以及D中Ba(NO3)2均为可溶性盐,而C中的ZnS和BaSO4均为难溶性盐。
本题难度:一般
2、选择题 在KClO3+6HCl=3Cl2↑+ KCl+3H2O中,有30 mole-转移,生成的氯气在标准状况下的体积为(?)
A.22.4L
B.336.0L
C.403.2L
D.672.0L
参考答案:B
本题解析:从题中可知,每生成3molCl2↑,就有5mol电子发生转移,那么当有30 mole-转移时,生成的氯气为18mol,在标准状况下的体积为403.2L,选C。
本题难度:一般
3、选择题 向含0.78molFeCl2溶液中通入0.09molCl2,再加入100mL1mol/L的X2O72-酸性溶液,使溶液中的Fe2+恰好全部氧化,则产物中X的化合价为
A.+1
B.+2
C.+3
D.+5
参考答案:C
本题解析:Fe2+-e-=Fe3+? Cl2-2e-=2Cl-
可见Fe2+共失去0.78mole-,氯气得到0.18mole-,0.1mol的X2O72-得到0.6mole-;而X2O72-中X的化合价为+6价,则可设产物中X的化合价为+n:0.1×2×(6—n)=0.6,得n=3,答案为C
本题难度:一般
4、选择题 含铬Cr2O72-废水用硫亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
A.消耗硫酸亚铁铵的物质量为n(3x+1)mol
B.处理废水中Cr2O72-的物质量为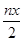 mol
mol
C.反应中发生转移的电子数为1.5nxmol
D.在FeO·FeyCrxO3中3x=y
参考答案:C
本题解析:A.由铁元素守恒,消耗硫酸亚铁铵的物质的量为n(y+1),又由FeO?FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁铵的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,A正确;B.根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为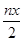 mol,B正确;C.得到nmolFeO·FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,C错误;D、FeO·FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y,D正确.
mol,B正确;C.得到nmolFeO·FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,C错误;D、FeO·FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y,D正确.
选:C.
本题难度:一般
5、计算题 3.16 g KMnO4与50mL 12 mol·L-1过量浓盐酸完全反应(假设浓盐酸无挥发),化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl 2+ 5Cl2↑+8H2O,?通过计算回答:
(1)未被氧化的HCl的物质的量是?;
(2)产生的Cl2在标准状况下的体积为多少升?
(3)在反应后的溶液中加足量的AgNO3溶液可生成多少克沉淀?
参考答案:0.06mol 1.12L? 71.75g
本题解析:KMnO4的物质的量=3.16/158=0.02,设需要HCl的物质的量是Xmol,生成Cl2的物质的量是Ymol,MnCl 2的物质的量为Zmol。
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2? 16? 5
0.02? X? Y
得:X=0.16? Y=0.05?
根据氧化反应的概念可知,元素的化合价升高被氧化,Cl元素的化合价一部分升高,一部分不变,所以HCl是部分被氧化.从化学方程式可以看出,16个Cl原子中有10个原子的化合价升为0价,因此未被氧化HCl占总的HCl的6/16,因此被氧化的HCl的物质的量=0.16×6/16=0.06mol。故Cl2在标准状况下的体积=0.×22.4=1.12L。氯离子的物质的量为0.05L×12 mol·L-1-0.05mol×2=0.5mol,故氯化银的质量为0.5mol×(108g/mol+35.5g/mol)=71.75g。
本题难度:简单