| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《化学基本概念》考点巩固(2017年最新版)(四)
参考答案:C 本题解析:A.在上述反应中Hg发生氧化反应,而CuI发生还原反应,错误;B.在上述反应中CuI是氧化剂,错误;C.根据化合物的化合价的代数和为0,可知:在上述反应的产物Cu2HgI4中,Hg的化合价为+2,正确;D.上述反应中生成 64g Cu时,转移的电子数为6.02×1023,错误。 本题难度:一般 3、选择题 从氧化还原角度分析,下列反应中水的作用相同的是 |
参考答案:C
本题解析:A:3Fe+4H2O  Fe3O4+4H2↑;B:2Na2O2+2H2O=NaOH+O2↑,过氧根中的氧呈-1价,是中间价态,所以过氧化钠即有氧化性又有还原性,与水反应发生的是氧化还原反应;C:Cl2+H2O=HCl+HClO,氯元素的化合价有升有降,是氧化还原反应;D:3NO2+H2O=2HNO3+NO,是氧化还原反应,故选C
Fe3O4+4H2↑;B:2Na2O2+2H2O=NaOH+O2↑,过氧根中的氧呈-1价,是中间价态,所以过氧化钠即有氧化性又有还原性,与水反应发生的是氧化还原反应;C:Cl2+H2O=HCl+HClO,氯元素的化合价有升有降,是氧化还原反应;D:3NO2+H2O=2HNO3+NO,是氧化还原反应,故选C
考点:氧化还原反应
点评:正确写出化学方程式是解本题的关键,难度不大
本题难度:一般
4、选择题 下列反应是氧化还原反应的是
A.CaCO3+2HCl===CaCl2+H2O+CO2↑
B.CaO+H2O===Ca(OH)2
C.2KMnO4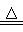 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.CaCO3 CaO+CO2↑
CaO+CO2↑
参考答案:C
本题解析:氧化还原反应是有元素化合价变化的化学反应,在2KMnO4 K2MnO4+MnO2+O2↑反应中Mn、O元素的化合价变化,故C项正确。
K2MnO4+MnO2+O2↑反应中Mn、O元素的化合价变化,故C项正确。
考点:本题考查氧化还原反应。
本题难度:一般
5、选择题 下列化学方程式中电子转移不正确的是
| A. | 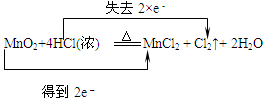 |
| B. | 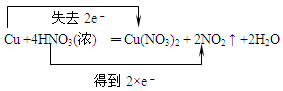 |
| C. | 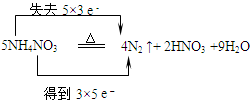 |
| D. | 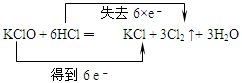 |
参考答案:D
本题解析:在氧化还原反应中:物质所含元素化合价升高或降低的数值就是该元素的一个原子失去或得到电子的数目。元素化合价升高总数与降低的总数相等。即电子守恒。D中物质中化合价的变化是:KClO3→Cl2.每个氯得到5个电子,应该写成得到5e-.HCl→Cl2。每个氯失去1个电子,共有5个氯失去电子。应该写成失去5×e-。错误。
考点:氧化还原反应的双线桥法表示等的知识。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《物质结构和.. | |