1、选择题 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标)和加入铁粉的物质的量(横坐标)之间的关系如图所示,则原溶液中Fe(NO3)3、 Cu(NO3)2、HNO3物质的量浓度之比为
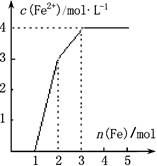
A.1∶1∶1
B.3∶3∶8
C.1∶3∶1
D.1∶1∶4
参考答案:B
本题解析:试题分析:先得比较这三种氧化剂的氧化性强弱:HNO3>Fe(NO3)3>Cu(NO3)2。反应中所涉及到的方程式为:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
1mol? 4mol? 1mol
Fe+2Fe(NO3)3=3Fe(NO3)2
1mol? 2mol? 3mol
Fe+Cu(NO3)2=Fe(NO3)2+Cu
1mol? 1mol? 1mol
从以上关系可以看出,n(HNO3)︰n(Fe(NO3)3)︰n(Cu(NO3)2)=1︰1︰4又因为同在一个溶液中,
所以:c(HNO3)︰c(Fe(NO3)3)︰c(Cu(NO3)2)=1︰1︰4
考点:氧化还原反应中的竞争反应的有关知识。
本题难度:简单
2、选择题 向下列溶液中分别加入AgNO3溶液和稀硝酸溶液,能生成不溶于水的白色沉淀的是
A.氯水
B.氯酸钾?
C.氯化钾
D.四氯化碳?
参考答案:AC
本题解析:能够与Ag+产生白色沉淀的是氯离子,而B、D中均不存在Cl-。
本题难度:困难
3、选择题 下列实验方案不能达到预期目的是
A.将含有HCl的CO2气体通过饱和NaHCO3溶液
B.向X溶液中滴加盐酸酸化的BaCl2溶液
C.向醋酸钠溶液中滴入酚酞试液,加热后若红色加深
D.向含有少量苯酚的苯中加入NaOH溶液,振荡、静置、分液
参考答案:B
本题解析:分析:A、根据除杂质题最少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应时不能引进新的杂质;
B、SO42-离子的检验方法:先加稀盐酸,再加入BaCl2溶液,产生白色沉淀;
C、根据醋酸钠水解溶液呈碱性,碱能使酚酞变红,碱性越强,颜色越深,平衡正向移动,再联系平衡移动与温度的关系;
D、根据除杂质题最少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应时不能引进新的杂质.
解答:A、CO2不与饱和NaHCO3溶液发生反应;HCl气体会与饱和NaHCO3溶液发生反应,HCl气体会被除去,同时生成CO2,没有引入杂质,故A正确;
B、先加稀盐酸,可以排除银离子与碳酸根离子,再加入BaCl2溶液,产生的沉淀只能是硫酸钡,向X溶液中滴加盐酸C酸化的BaCl2溶液产生白色沉淀,可能是硫酸钡,也可能是氯化银,故B错误;
C、醋酸钠水解溶液呈碱性,碱能使酚酞变红,碱性越强,颜色越深,加热后若红色加深,说明平衡正向移动,即温度升高,平衡正向移动,即盐类的水解是吸热的,故C正确;
D、苯酚与NaOH溶液反应,生成苯酚钠和水,苯与NaOH溶液反应不反应,溶液分层,分液即可得到纯净的苯,故D正确;
故选B.
点评:本题主要考查了盐类的水解、物质的除杂,需要注意的是除杂时选择适当除杂剂和分离方法,要符合除杂的原则,就是原物质的质量不能减少,但可以增加,不能带入新的杂质,除杂剂不能和原物质反应.
本题难度:简单
4、填空题 (17分)(1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO===Cu+H2O所属的区域。
② “四种基本反应类型与氧化还原反应的关系”也可用B图表达。其中Ⅰ为化合反应,则Ⅱ为 反应。写出有水生成的符合反应类型Ⅲ的一个化学方程式: 。

(2)已知反应:①SO3+H2O===H2SO4
②Cl2+H2O===HCl+HClO
③2F2+2H2O===4HF+O2
④2Na+2H2O===2NaOH+H2↑
⑤2Na2O2+2H2O===4NaOH+O2↑
⑥SiO2+2NaOH===Na2SiO3+H2O
上述反应中不属于氧化还原反应的有 (填序号,下同);H2O被氧化的是 ,H2O被还原的是 ,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是 。
(3)反应2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,Mn元素的化合价由 价变为 价,被 ; 元素的原子失去电子,被 ;若参加反应的HCl是73 g,则被氧化的HCl是 g。
(4)根据反应①2FeCl3+2KI===2FeCl2+2KCl+I2,
②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的( )
A.Fe3+>Cl2>I2
B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+
D.Cl2>Fe3+>I2