1、选择题 设阿伏加德罗常数为NA。则下列说法正确的是
[? ]
A.常温常压下,6g He所含有的中子数目为2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
参考答案:C
本题解析:
本题难度:简单
2、选择题 1g?NH3含m个氢原子,则阿伏加德罗常数为
A.17m
B.3m
C.
D.
参考答案:D
本题解析:分析:根据氨气分子的构成、结合n=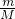 N=n×NA来计算.
N=n×NA来计算.
解答:1g?NH3物质的量=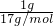 =
=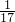 mol;
mol;
氨气分子是由一个氮原子和3个氢原子构成,则氢原子物质的量=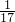 mol×3=
mol×3=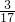 mol;
mol;
由N=n×NA可知,
阿伏加德罗常数可表示为NA=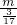 /mol=
/mol=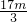 /mol
/mol
故选D.
点评:本题考查阿伏伽德罗常数的计算,明确质量、物质的量、微粒数目的关系是解答本题的关键,并注意不同字母表示的意义来解答.
本题难度:简单
3、选择题 设NA代表阿伏伽德罗常数,下列说法正确的是( )
A.1?mol?MgCl2中含有的离子数为2NA
B.标准状况下,11.2?L?H2O中含有的原子数为1.5NA
C.0.5?mol/LFe2(SO4)3溶液中,SO
的数目为1.5NA
D.常温下,2.7?g铝与足量的盐酸反应,失去的电子数为0.3NA
参考答案:A、氯化镁是强电解质溶液中全部电离,1 mol MgCl2中含有的离子数为3NA,故A错误;
B、标准状况,水不是气体,11.2 L H2O物质的量不是0.5mol,故B错误;
C、溶液体积不知不能计算微粒数,故C错误;
D、常温下,2.7 g铝与足量的盐酸反应,失去的电子数为0.3NA,故D正确;
故选D.
本题解析:
本题难度:简单
4、选择题 设 表示阿伏加德罗常数,下列叙述中正确的是
表示阿伏加德罗常数,下列叙述中正确的是
①.31g白磷含有的P—P键数为 ②. 1mol
②. 1mol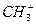 (碳正离子)中含有电子数为10
(碳正离子)中含有电子数为10 ③. 1mol铜与足量硫蒸气反应,转移电子数为2
③. 1mol铜与足量硫蒸气反应,转移电子数为2 ④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2
④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2 个电子 ⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA ⑥.0.84 g
个电子 ⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA ⑥.0.84 g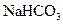 晶体中阳离子和阴离子总数为0.03
晶体中阳离子和阴离子总数为0.03 ⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA ⑧.标准状况下,3.2g铜与足量的浓硝酸反
⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA ⑧.标准状况下,3.2g铜与足量的浓硝酸反 应生成的气体含有的分子数是0.1NA ⑨.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023 ⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
应生成的气体含有的分子数是0.1NA ⑨.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023 ⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
A ②④⑦⑧ B ③④⑥⑦⑧ C ④⑦ D④⑥⑨⑩
参考答案:C
本题解析:略
本题难度:一般
5、选择题 设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.3.4gNH3中含N-H键数目为0.2NA
B.27g?Al在22.4L?Cl2中燃烧,转移的电子总数为3?NA
C.0.5mol?L-1CuCl2溶液中含Cl-数为NA
D.84?g?NaHCO3与MgCO3的混合物中所含氧原子数目为3NA
参考答案:A、3.4gNH3物质的量为0.2mol,1molNH3分子中含N-H键数3mol,所以0.2mol氨气分子含N-H键数0.6mol,故A错误;
B、27g?Al物质的量为1mol,22.4L?Cl2由于温度和压强未知,物质的量不能计算,故B错误;
C、0.5mol?L-1CuCl2溶液中含Cl-物质的量浓度为1mol/L,但体积不知,无法计算离子数,故C错误;
D、NaHCO3与MgCO3的摩尔质量相同,所以84?g?NaHCO3与MgCO3的混合物物质的量为1mol,因为二者含氧原子相同,所以所含氧原子数目为3NA,故D正确;
故选D.
本题解析:
本题难度:简单