1、推断题 X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是__________________________________(用元素符号表示)。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________,该族2~5周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号)。
a.+99.7 kJ·mol-1 ?b.+29.7 kJ·mol-1? c.-20.6 kJ·mol-1? d.-241.8 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式:____________________;由R生成Q的化学方程式为:________________________。
参考答案:(1)O;第三周期第ⅢA族;Al>C>N>O>H 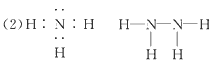
(3)34;H2SeO4;b
(4)Al+3HCO3--3e-===Al(OH)3↓+3CO2↑ (或Al-3e-===Al3+、Al3++3HCO3-===Al(OH)3↓+3CO2↑)
2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
本题解析:
本题难度:一般
2、填空题 下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
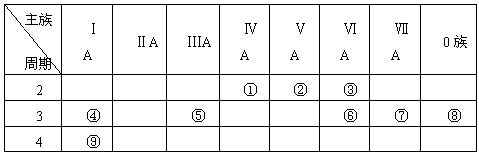
(1)填写上表。
(2)?在这些元素中,化学性质最不活泼的是:_______________(填具体符号,下同)。
(3) 在最高价氧化物的水化物中,酸性最强的化合物的化学式是_____ ,碱性最强的化合物的电子式是:_____________。
(4)?最高价氧化物是两性氧化物的元素是_____ ;写出它的氧化物与氢氧化钠反应的离子方程式________________________________。
(5)?④与⑥形成的化合物的电子式:__________,该化合物属于 ___(填 “共价”或“离子”)化合物。
(6)①与③形成的化合物的电子式_________,该化合物属于____(填 “共价”或“离子”)化合物。
参考答案:(1)“略”
(2)Ar
(3)HClO4;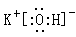
(4)Al;Al2O3+2OH-=2AlO2-+H2O
(5)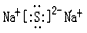 ;离子 ;离子
(6)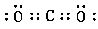 ;共价 ;共价
本题解析:
本题难度:一般
3、选择题 下列说法中错误的是
[? ]
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
参考答案:AD
本题解析:
本题难度:简单
4、选择题 下列各组元素的性质递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的金属性依次增强
参考答案:A、Li、Be、B原子最外层电子数依次为1、2、3,逐渐增多,故A正确;
B、P、S、Cl元素最高正价依次为+5、+6、+7,逐渐升高,故B正确;
C、N、O、F是同周期元素的原子,从左到右,原子半径依次减小,故C错误;
D、Na、K、Rb是同主族元素,从上到下的金属性依次增强,故D正确.
故选C.
本题解析:
本题难度:简单
5、推断题 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。

(1)写出B原子的电子排布式________。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点____(填“高”或“低”),其原因是_____________________。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点________(填“高”或“低”),其原因是____________________。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________,简要描述该配合物中化学键的成键情况______________________。
参考答案:(1)1s22s22p63s23p4
(2)高;因为A的氢化物存在氢键
(3)低;晶体类型不同
(4)[Cu(NH3)4]SO4;中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合
本题解析:
本题难度:一般
|