1、选择题 下列关于物质性质变化的比较,正确的是
A.非金属性强弱: C>Si>P
B.原子半径大小: Na > S > O
C.金属性性强弱: Mg > Na> Li
D.还原性强弱: F- > Cl- > I-
参考答案:B
本题解析:
本题难度:简单
2、简答题 下表是元素周期表的一部分,回答下列问题:
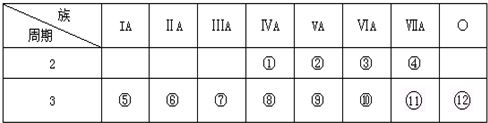
(1)写出②元素的名称______⑧元素的符号,______.
(2)在这些元素中,______(用元素符号填写,下同)是最活泼的金属元素;______是最活泼的非金属元素;______是最不活泼的元素.
(3)这些元素的最高价氧化物的对应水化物中______酸性最强;______碱性最强;两性氢氧化物是______.写出以上能反应的化学方程式(至少二个):______
(4)从⑤到11的元素中,______原子半径最小
(5)比较⑤与⑥的化学性质,______更活泼,试用实验证明此现象(简述操作、现象和结论)______.
参考答案:(1)根据元素周期表的结构可知②为N,⑧为Si,故答案为:氮;Si;
(2)根据元素周期表性质的递变规律,最活泼的金属应在第IA,最活泼的非金属应在第VIIA,惰性气体最不活泼,则在IA元素Na最活泼;在VII元素④F最活泼;最不活泼的是Ar,
故答案为:Na;F;Ar;
(3)元素的最高价氧化物对应水化物中,酸性最强的必是非金属性增强的,根据同周期、同主族元素非金属性的递变规律可知,元素非金属性最强的是②即F,但F无最高正价.因为我们知道,HClO4已知的最高价含氧酸中酸性最强的,即酸性最强的是HClO4,元素的最高价氧化物对应水化物中,碱性最强的必是非金属性增强的,根据同周期、同主族元素金属性的递变规律可知,元素金属性最强的是⑤即Na,则碱性最强的必是NaOH,在表中所列元素的最高价氧化物对应水化物中,只有Al(OH)3具有两性,既能和强酸高氯酸之间反应又能和强碱氢氧化钠之间反应,发生的反应可以是:HClO4+NaOH=NaClO4+H20、NaOH+Al(OH)3=Na[Al(OH)4]、3HClO4+Al(OH)3=Al(ClO4)3+3H2O,
故答案为:HClO4;NaOH;Al(OH)3;HClO4+NaOH=NaClO4+H20、NaOH+Al(OH)3=Na[Al(OH)4]、
3HClO4+Al(OH)3=Al(ClO4)3+3H2O;
(4)根据元素周期律:周期表中,同周期元素原子从左到右原子半径逐渐减小,所以半径最小的是Cl,故答案为:Cl;
(5)⑤和⑥分别是Na和Mg,根据同主族元素金属性的递变规律可知,金属性Na>Mg,根据判断金属性强弱的方法,可依据二者单质分别与水反应的剧烈程度来判断其金属性强弱,即与H2O反应,
故答案为:Na;金属钠和金属镁的单质分别与冷水反应, 反应剧烈程度大的是金属钠,反之是金属镁.
本题解析:
本题难度:一般
3、选择题 具有相同电子层数的X、Y、Z三种元素,已知它们最高价氧化物对应的水化物的酸性强弱顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是
A.原子半径:X>Y>Z
B.元素的非金属性:X>Y>Z
C.气态氢化物的稳定性:HX<H2Y<ZH3
D.阴离子的还原性:X->Y2->Z3-
参考答案:B
本题解析:根据元素周期律题目所给条件,可以举特例X、Y、Z三种元素分别为:Cl、S、P,然后对各选项进行比较.选项A中,应为Z>Y>X;选项C中,应为ZH3<XH2<HY;选项D中,应为Z3->Y2>X-,故答案:选B项.
本题难度:困难
4、推断题 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含一种金属元素。A和D最外层电子数相 同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙)。
请回答下列问题:
(1)甲的电子式为___________;写出乙的一种用途____________。
(2)用某种废弃的金属易拉罐和碳棒作电极,以A、C、D 组成的化合物溶液为电解质溶液,构成原电池,写出负极的电极反应式________________。
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为________________。反应后的溶液中浓度最大的离子为__________(写离子符号)。
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目
___________________。
参考答案:(1) ;杀菌、消毒
;杀菌、消毒
(2)Al+4OH--3e-=AlO2-+2H2O?
(3)NH4NO2+AgNO3=AgNO2↓+NH4NO3;NO3- (4)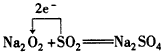
本题解析:
本题难度:一般
5、填空题 下列为元素周期表中的一部分,按要求回答下列问题.
| ⅠA | | 0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
⑤
3
⑥
⑦
⑧
⑨
4
=10 ⑩
|
(1)这些元素中最不活泼的元素名称为:______;
(2)元素⑥⑦=10 ⑩的最高价氧化物对应的水化物中碱性最强的是:______;
(3)元素⑨的单质与H2O反应的离子方程式为:______;
(4)元素③的单质电子式为______;
(5)元素①③⑨形成的化合物中的化学键类型为:______.
(6)比较元素⑥⑦⑧⑨离子的半径由大到小的顺序为:______.
参考答案:根据元素在周期表中的分布,可以推知①是H,②是C,③是N,④是O,⑤是Ne,⑥是Na,⑦是Mg,⑧是S,⑨是Cl,⑩是K.
(1)稀有气体元素的化学性质最不活泼,应该是Ne,故答案为:氖;
(2)周期表中从左到右元素最高价氧化物对应水化物的碱的碱性逐渐增减弱,从上到下元素最高价氧化物对应水化物的碱的碱性逐渐增强,所以碱性最强的是KOH,故答案为:KOH;
(3)氯气和水反应生成盐酸和次氯酸,离子方程式为:Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(4)氮气是含有氮氮三键的物质,它的电子式为:

,故答案为:

;
(5)①③⑨三元素形成的化合物为NH4Cl,为离子化合物,含有离子键和共价键,故答案为:离子键和共价键;
(6)离子的电子层越多半径越大,所以硫离子、氯离子的半径大于钠离子、镁离子,对于核外电子排布相等的离子,则核电荷数越多半径越小,
所以离子半径顺序是:S2->Cl->Na+>Mg2+,故答案为:S2->Cl->Na+>Mg2+.
本题解析:
本题难度:一般