1、选择题 下列说法正确的是( )
A.难溶电解质的溶度积越小,溶解度越大
B.可以通过沉淀反应使杂质离子完全沉淀
C.难溶电解质的溶解平衡是一种动态平衡
D.一定浓度的氨水溶液可以溶解Mg(OH)2
参考答案:A、溶度积比较物质溶解度的条件是阴阳离子组成比相同的可以用溶度积大小比较,难溶电解质的溶度积越小,溶解度越小,故A错误;
B、难溶物存在沉淀溶解平衡,不能完全沉淀,溶液中离子浓度达到10-6mol/L,即可认为沉淀完全,通过沉淀反应不能使杂质离子完全沉淀,故B错误;
C、难溶电解质的溶解平衡是一种动态平衡,沉淀和溶解速率相同,同时进行,故C正确;
D、氢氧化镁不溶于碱,故D错误;
故选C.
本题解析:
本题难度:一般
2、计算题 难溶化合物的饱和溶液存在溶解平衡,例如:AgCl(s)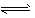 Ag(sq)+Cl(aq),
Ag(sq)+Cl(aq),
Ag2CrO4(s)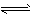 2Ag(aq)+CrO42-(aq),一定温度下,其离子浓度乘积为常数,这一常数叫溶度积常数,用Ksp表示,已知:
2Ag(aq)+CrO42-(aq),一定温度下,其离子浓度乘积为常数,这一常数叫溶度积常数,用Ksp表示,已知:
Ksp(AgCl)=c(Ag)·c(Cl-)=1.8×10 -10,
Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=1.9×10-12,
现用0. 01mol/L的AgNO3溶液溶液滴定0. 01mol/L的KCl和0.001mol/L K2CrO4混合溶液,通过计算回答:
(1) Cl-、CrO42-谁先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是多少?(设混合溶液在反应中体积不变)(已知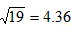 )
)
参考答案:(1)当Cl-开始沉淀时,需要c(Ag+)=1.8×10-8 mol/L,当CrO42- 开始沉淀时,需要c(Ag+)=4. 36×10 -5 mol/L>1.8×10-8 mol/L, 所以Cl-先沉淀。
(2)当刚出现Ag2CrO4沉淀时,c(Cl-) =4. 13× 10-6 mol/L
本题解析:
本题难度:一般
3、填空题 炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉(Cd)是一个有益的尝试,其流程如下:
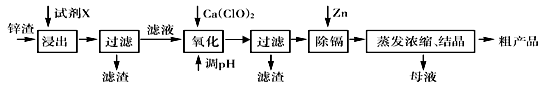
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7。试回答下列问题:
(1)浸出时用到的试剂X为 , 写出溶解过程中加快浸出速率和提高浸出率的两点措施:_______________________________,______________________________。
(2)写出加入Ca(ClO)2反应的离子方程式 。
(3)调节pH过程可以选用 (填“ZnO”或“NaOH”);本流程的pH调节一般调至5,其目的是 。
(4)写出过滤后加入过量的锌粉反应的离子方程式 。
(5)在蒸发浓缩操作时,要采取实验措施是: 。
参考答案:(1)H2SO4溶液 适当升温、充分搅拌、延长溶解时间等(其它答案合理也给分)
(2)2H++ClO—+2Fe2+ =Cl—+2Fe3++H2O(配平错扣1分)
(3)ZnO ,除去Fe3+和Al3+,防止Zn2+沉淀析出
(4)Zn+Cd2+=Zn2++Cd (5)保持一定的酸度(其它表达合理也给分)
本题解析:(1)本题是制备硫酸锌晶体的的工艺流程,锌渣中含有难溶的二氧化硅杂质,选用酸溶除去二氧化硅,考虑尽量少引入杂质,应选含有硫酸根离子的硫酸溶液进行溶解。若要加快浸出速率和提高浸出率,可以适当升高温度或搅拌溶液或适当延长时间等。
(2)用硫酸浸出的滤液中含有少量Fe3+、Al3+、Zn2+、Cd2+、Fe2+ 等离子,考虑这些离子分别沉淀的pH值,应该把Fe2+ 氧化为Fe3+ 在沉淀除去,所以加入氧化剂Ca(ClO)2 发生的反应方式为:2H++ClO—+2Fe2+ =Cl—+2Fe3++H2O。
(3)由于整个流程制备的是硫酸锌晶体,所以在调节pH时要注意不能引入杂质,所以应该选用ZnO调节,而调节pH值到5左右目的是使容易沉淀的Fe3+、Al3+ 先沉淀除去,防止pH过高把生成的Al(OH)3溶解、把Zn2+ 沉淀。
(4)在上步调节完pH后,溶液中还存在杂质离子Cd2+ ,由于Cd2+ 沉淀的pH值与Zn2+ 沉淀的pH值相近,所以不能用沉淀法除去,所以要加入单质Zn把Cd置换出来,因此发生的离子方程式为:Zn+Cd2+=Zn2++Cd。
(5)硫酸锌在蒸发浓缩时容易发生水解,所以为了减少水解产生杂质,应该保持溶液一定的酸度。
考点:本题考查的是化学工艺流程题,本题考的比较基础,常规题型较多。
本题难度:困难
4、填空题 (10分)据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ?△H=" -556.0" kJ·mol-1
③ H2O(g)=H2O(l)?△H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
参考答案:(1) c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);(2)CO+4OH—-2e-=CO32-+2H2O;
(3) 2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;(4)5.6×10-5mol/L;
(5) CH3OH(L)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-725.8KJ/mol。
本题解析:(1)n(CO2)=" 0.4mol" ,n(NaOH)= 0.2L×3mol/L=0.6mol.假设反应后产物中含Na2CO3、NaHCO3 的物质的量分别是x、y,则根据C元素守恒可得x+y=0.4mol;根据Na元素守恒可得2x+y=0.6mol。解得x=y=0.2mol。所以溶液是Na2CO3、NaHCO3等物质的量浓度的混合溶液。根据物料守恒可知离子浓度最大的是c(Na+)。由于二者都要水解消耗水电离产生的H+,所以最终溶液中c(OH-)>c(H+),而CO32-水解的程度大于HCO3-的水解程度,所以c(HCO3-)>c(CO32-);但是盐的水解程度是微弱的,在溶液中主要还是以盐电离产生的离子存在,盐电离产生的离子浓度远大于弱电解质水的电离产生的离子,所以c(CO32-)>c(OH-)。溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,通入燃料的电极是负极,电极反应方程式为CO+4OH—-2e-=CO32-+2H2O;(3) 由于Fe2+、Fe3+对SO2的转化有催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;(4)假设生成沉淀所需CaCl2溶液的最小浓度为x,由于溶液等体积混合时各种物质的浓度都减小一半,所以 (x/2)×[(2×10—4mo1/L)÷2]≥2.8×10—9=5.6×10-5mol/L;(5)①+②÷2+③×2,整理可得:CH3OH(L)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-725.8KJ/mol。
考点:考查微粒浓度的比较、燃料电池电极反应式和离子方程式、热化学方程式的书写的知识。
本题难度:困难
5、选择题 已知CuSO4溶液分别与Na2CO3、Na2S溶液的反应情况如下:?据此判断,下列几种物质Ksp大小的比较中正确的是?
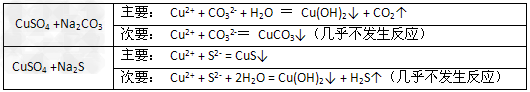
[? ]
A.Cu(OH)2<CuS?<CuCO3?
B.CuS?<Cu(OH)2<CuCO3?
C.CuCO3<Cu(OH)2<CuS?
D.CuCO3?<CuS?<?Cu(OH)2
参考答案:B
本题解析:
本题难度:一般