1、选择题 下列关于沉淀溶解平衡的说法错误的是? (? )
A.难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡
B.Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关
C.Ksp反映了物质在水中的溶解能力,可直接根据Ksp的数值大小比较电解质在水中的溶解能力大小
D.可以通过浓度商(Qc)和Ksp的相对大小,来判断沉淀溶解平衡的移动方向
2、填空题 (4分)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
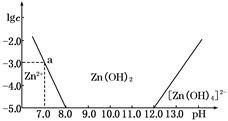
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
c(HCl)
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(mol/L)
| 0.50
| 1.00
| 2.04
| 2.90
| 4.02
| 5.16
| 5.78
|
103c(PbCl2)
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(mol/L)
| 5.10
| 4.91
| 5.21
| 5.90
| 7.48
| 10.81
| 14.01
|
根据上表数据判断下列说法正确的是________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
3、填空题 在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g)?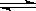 ?CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
?CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
t℃
| 700
| 800
| 850
| 1000
| 1200
|
K
| 2.6
| 1.7
| 1.0
| 0.9
| 0.6
|
(1) K的表达式为: ? ? ;该反应的正反应为 ? 反应(“吸热”或“放热”)
(2) 能判断该反应是否已经达到化学平衡状态的是:?
A.容器中压强不变 ?B.混合气体中CO浓度不变
C.v(H2)正= v(H2O)逆 ? D.c(CO2) = c(CO)
(3)某研究小组利用反应:CO(g)+H2O(g)  ?H2(g)+CO2(g) ?△H=-41.2kJ/mol,制备CO2与H2的混合气体。用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L1.5mol/L的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是?。
?H2(g)+CO2(g) ?△H=-41.2kJ/mol,制备CO2与H2的混合气体。用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L1.5mol/L的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是?。
(4)如将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)  ?CO2(g)+ 2H2O(1)?ΔH1=-890.3 kJ/mol?
?CO2(g)+ 2H2O(1)?ΔH1=-890.3 kJ/mol?
H2(g) + 1/2O2(g)  ?H2O(1)?ΔH2=-285.8 kJ/mol?
?H2O(1)?ΔH2=-285.8 kJ/mol?
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是?。
(5)熔融盐燃料电池如下图:
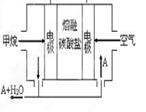
该图是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。正极的电极反应是_______?。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环,则A物质的化学式是_________。实验过程中,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4____________L。
4、选择题 牙齿表面由一层硬的成分为Ca5(PO4)3OH的物质保护,它在唾液中存在下列平衡:
Ca5(PO4)3OH 5Ca2++3 PO43-+OH-。已知Ca5(PO4)3F(s)的溶解度比a5(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。以下措施中不能保护牙齿的是(?)
5Ca2++3 PO43-+OH-。已知Ca5(PO4)3F(s)的溶解度比a5(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。以下措施中不能保护牙齿的是(?)
A.饮用纯净水
B.在牙膏中添加适量的Ca2+或PO43-离子
C.在饮用水中加入适量氟化物添加剂
D.在牙膏中加入氟化物添加剂
5、选择题 25℃时,水的电离达到平衡:H2O H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀醋酸,平衡逆移,c(H+)降低
B.将水加热,KW增大,pH不变
C.向水中加入少量固体硫酸氢钾,c(H+)增大,KW不变
D.pH=10的NaOH溶液与pH=10的NaClO溶液中,水电离c(H+)之比等于106