1、选择题 .短周期元素X、Y、Z、M、R在周期表中的相对位置如下图所示。下列说法中不正确的是(?)

A.元素X和Y可以形成两种以上的气态化合物
B.原子半径的大小顺序为:r(Z)>r(M)>r(R)
C.元素的最高价氧化物对应水化物的酸性R强于M
D.加热蒸干由元素B和Z形成的化合物的水溶液可以得到该化合物的晶体
参考答案:D
本题解析:根据与元素周期表比较,可以确定X、Y、Z、M、R分别是N、O、Al、S、Cl。蒸干AlCl3过程中,加速其水解,生成HCl挥发,最终得到的是Al2O3。
本题难度:一般
2、选择题 可以验证硫元素的非金属性比氯元素弱的事实是
①H2S水溶液是弱酸,HCl水溶液是强酸?②向氢硫酸溶液中滴入氯水有单质硫生成?③硫、氯气分别与铜和铁反应,其产物是FeS、Cu2S、FeCl3、CuCl2?④高氯酸(HClO4)的酸性比硫酸强
A.②③④
B.②④
C.①②④
D.①②③④
参考答案:A
本题解析:①不能根据氢化物水溶液的酸性比较非金属性,错误;②Cl2能把S2?氧化为S,说明Cl元素的非金属性大于S元素,正确;③S把Cu、Fe氧化为较低价态,Cl2把Cu、Fe氧化为较高价态,说明Cl元素的非金属性大于S元素,正确;④高氯酸为Cl元素最高价氧化物的水合物,硫酸为S元素最高价氧化物的水合物,高氯酸(HClO4)的酸性比硫酸强,说明Cl元素的非金属性大于S元素,正确,故A项正确。
本题难度:一般
3、选择题 能正确表示CH4中碳原子的成键轨道的示意图为( )
 ?
?
参考答案:D
本题解析:甲烷是正四面体型结构,其中碳原子是sp3杂化,所以碳原子的成键轨道的示意图为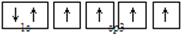 ,答案选D。
,答案选D。
点评:该题设计新颖,基础性强,侧重对学生能力的培养。该题的关键是明确甲烷分子中碳原子的杂化轨道类型,然后灵活运用即可,有利于调动学生的学习积极性,提高学生的应试能力。
本题难度:一般
4、选择题 下列价电子排布式表示的四种元素中,电负性最大的是
A.4s1
B.2s22p5
C.3s23p4
D.3d64s2
参考答案:B
本题解析:由价电子排布式可知,四种元素分别是K、F、S、Fe,电负性最大的是F。
点评:电负性最大也即是吸电子能力最强,解题的技术是结合选项,吸电子能力越强,电负性越强。
本题难度:一般
5、选择题 某阳离子Mn+的核外共有x个电子,核内有a个中子,则M的质量数为?
A.a+x-n
B.a+x+n
C.a-x-n
D.a-x+n
参考答案:B
本题解析:阳离子Mn+的核外共有x个电子,则该微粒的质子数=x+2。又因为质子数+中子数=质量数,则质量数=x+2+a,答案选B。
点评:该题是高考中的常见题型,试题以核燃料为载体,重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性。
本题难度:一般