1、填空题 现有X、Y、Z、W四种短周期元素原子序数依次增大,其原子半径及主要化合价如下表所示。又知X与Y、Z与W分别位于同一周期,Y、W处于同一主族。
元素
| X
| Y
| Z
| W
|
原子半径/nm
| 0.077
| 0.074
| 0.186
| 0.102
|
主要化合价
| -4,+4
| -2
| +1
| -2,+6
|
请回答:
小题1:X位于元素周期表的? ?,画出Z原子结构示意图? ?,
Z2W是离子晶体,写出其电子式? ?。
小题2:X单质能与某酸(H2WY4)的浓溶液发生反应,产物有XY2、WY2和水,
其反应的化学方程式为?;
小题3:Z2Y2可与XY2发生反应可给潜水艇供氧,其反应的化学方程式为?;
若反应中转移电子数为3.01×1023,则所得气体产物的体积是?(标准状况)。
小题4:Y、Z、W三种元素可组成质量比为5.75 : 8 : 4的某种化合物。实验室检验该化合物中所含阴离子的操作方法及有关实验现象是:取少量含该阴离子的溶液,?,则证明原溶液中含有该阴离子。
参考答案:
小题1:二周期ⅣA族?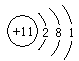 、
、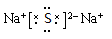
小题2:C + 2H2SO4(浓)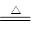 CO2 ↑+ 2SO2 ↑+ 2H2O
CO2 ↑+ 2SO2 ↑+ 2H2O
小题3:2Na2O2 + 2CO2 = 2Na2CO3 + O2↑? 5.60L
小题4:滴加少量的硝酸钡溶液(盐酸和氯化钡溶液),如产生白色沉淀
本题解析:考查元素周期表的结构和元素周期律的应用。根据化合价可知判断X、Y、Z、W
四种短周期元素分别属于第ⅣA、ⅥA、IA、ⅥA。因为同周期元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,所以X、Y、Z、W四种短周期元素分别为C、O、Na、S。过氧化钠和CO2的反应中,过氧化钠既作氧化剂,还是还原剂。根据方程式可判断每生成1mol氧气,反应中就转移2mol电子。所以当反应中转移电子数为3.01×1023,所得氧气是0.25mol,其体积是22.4L/mol×0.25mol=5.6L。O、Na、S三种元素的质量比为8 :5.75 : 4,则其原子个数之比是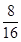 ︰
︰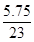 ︰
︰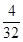 =4︰2︰1,所以该化合物是硫酸钠。检验SO42-可用盐酸酸化的氯化钡溶液即可。
=4︰2︰1,所以该化合物是硫酸钠。检验SO42-可用盐酸酸化的氯化钡溶液即可。
本题难度:一般
2、选择题 下图为元素周期表中短周期的一部分,下列说法错误的是
A.Z的原子序数可能是X的两倍
B.单质的活泼性可能是Y<Z
C.X、Z的最高价氧化物对应水化物可能均为强酸
D.分别由Y、W形成的单质可能都是原子晶体
参考答案:C
本题解析:A、X、Y为O和S,符合要求,正确;B、若YZ分别为氮气和白磷,符合要求,正确;C、错误;D、碳和硅形成的金刚石和晶体硅符合要求,正确。
本题难度:一般
3、选择题 已知a、b分别为同周期的ⅠA和ⅦA族的两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是
A.n=m+16
B.n=m+6
C.n=m+30
D.n=m+31
参考答案:D
本题解析:
分析:根据周期表的结构及每一周期元素的数目.
解:周期表中第一、二、三、四、五、六、七周期元素的种数分别为2、8、8、18、18、32、26,若元素在二、三周期,则原子序数n=m+6,若元素在四、五周期,由于副族和ⅥⅡ族出现在ⅠA和ⅦA族之间共10种元素,则原子序数n=m+6+10=m+16,若元素在第六周期,又多了镧系的出现,有15种元素,则原子序数n=m+16+14=m+30.
故选:D.
本题难度:简单
4、选择题 下列比较不正确的是
A.最高价氧化物对应水化物的酸性:H3PO4>H2SO4>HNO3
B.与冷水的反应速率:K>Na>Mg
C.热稳定性:HF>HCl>H2S
D.离子半径:Cl->F->Na+
参考答案:A
本题解析:同周期最高价氧化物对应水化物的酸性从左向右逐渐增强,故H2SO4>H3PO4, A不正确;根据金属与水反应难易的递变规律即同周期从左向右越来越难,同主族从上到下,越来越易,可得B正确;同一周期,从左向右,气态氢化物的稳定性逐渐增强,同一主族,从上到下,逐渐减弱,故C正确;D中氯离子有三个电子层,半径最大,氟离子和钠离子具有相同的核外电子排布,核电荷数越大,离子半径越小,故D正确;故选A。
本题难度:一般
5、简答题 【选修3-物质的结构与性质】(15分)

上表为周期表的一部分,其中的编号代表所对应的元素。请回答下列问题:
(1)⑨号元素的基态原子的价电子排布式是________,与其同周期,且基态原子的核外未成对电子数最多的元素是______(写出元素符号),②号元素基态原子的电子排布图为___。
(2) ①号与③号元素形成的含有18电子的物质为________(写出名称),②号与③号元素形成的,能造成温室效应的物质的空间构型为________。
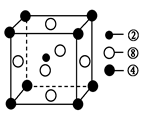
②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为________(用对应的元素符号表示),常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是____________。
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是________。
a.该分子属于含有极性键的非极性分子b.该分子含有4个σ键和1个π键
c.该分子中的②原子采取sp2杂化d.该物质易溶于水,并能和水反应得到酒精
(4)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为_______。
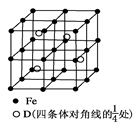
(5) 若D元素与Fe元素形成某种晶体如图所示。若晶胞的边长为a nm,则合金的密度为________g/cm3。
参考答案:(1) 3d104s1 (1分)?Cr (1分) ?
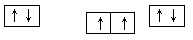 ?
?
(1分)
(2)?过氧化氢? (1分)?直线型 (1分)? MgNi3C或Ni3MgC? (2分)?
甲醇分子间存在氢键,而丙烯分子间只有范德华力? (2分)
(3)ac? (2分)
(4)先产生蓝色沉淀,后沉淀消失,溶液变成深蓝色? (2分)
(5 )? 0.92/a3或5.56×1023/(a3NA)? (2分)
本题解析:(1)⑨号元素为铜元素,基态原子的价电子排布式是3d104s1,与其同周期,且基态原子的核外未成对电子数最多的元素的电子排布式为[Ar]3d54s1是Cr,②号元素为碳元素,基态原子的电子排布图?

(2) ①号元素氢与③号元素氧形成的含有18电子的物质为过氧化氢,②号元素碳与③号元?素氧形成的,能造成温室效应的物质二氧化碳的空间构型为直线型。根据晶胞的结构利用切割法判断,1个晶胞中含有1个碳原子,镁原子8×1/8=1个,镍原子6×1/2=3个,C、Mg、Ni三种元素的原子形成的晶体的化学式为MgNi3C或Ni3MgC,常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是甲醇分子间存在氢键,而丙烯分子间只有范德华力。
(3)C、H两种元素能形成多种平面形分子,其中有一种相对分子质量最小为?乙炔,a.该分子中碳氢键为极性键,分子结构对称,属于含有极性键的非极性分子,正确;b.该分子含有2个碳氢键和1个碳碳三键,共3个σ键和2个π键,错误;c.该分子为直线型,碳原子采取sp1杂化,错误;d、该物质微溶于水,错误,选a;
(4)某元素的价电子排布式为nsnnpn+1,该元素为氮元素,可与元素氢形成含有10个电子的分子氨气,将过量的氨气通入盛有硫酸铜溶液的试管里,先发生复分解反应后发生络合反应,产生的现象为先产生蓝色沉淀,后沉淀消失,溶液变成深蓝色。
(5) 根据晶胞的结构先确定1个晶胞中含有各原子的个数,进一步确定化学式,结合密度的定义及相关数学知识进行计算。无法确定D元素,无法计算
本题难度:一般