1、选择题 某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液中肯定不存在的离子组是?
[?]
A.Al3+、Mg2+、I-、SO32-?
B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I-?
D.Al3+、CO32-、Br-、SO32-
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列用水就能鉴别的一组物质是
[? ]
A.苯、己烷、四氯化碳
B.苯、乙醇、四氯化碳
C.硝基苯、乙醇、四氯化碳
D.硝基苯、乙醇、乙酸
参考答案:B
本题解析:
本题难度:一般
3、简答题 现有Cu,Fe(OH)3及Al组成的混合物,进行实验后,变化关系如图所示,填写以下空白:
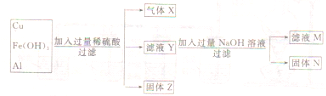
(1)气体X为______,固体乙为______,固体N为______.
(2)液体Y中除H-外还含有的阳离子为______和______.
(3)滤液M中含有的阴离子除SO
和OH-外还含有的是______.
参考答案:Cu,Fe(OH)3及Al中加入过量稀硫酸,Cu不与稀硫酸反应,所以固体Z为Cu;铝与稀硫酸反应生成氢气,则气体X为氢气,溶液Y中含有Fe3+和铝离子;Y溶液中加热过量强氧化溶液,铁离子与氢氧化钠反应生成Fe(OH)3,所以固体N为氢氧化铁,滤液M中含有偏铝酸根离子,
(1)根据以上分析可知,气体X为铝与稀硫酸反应生成的氢气,固体乙为铜,固体N为铁离子与氢氧化钠反应生成的红褐色沉淀氢氧化铁,
故答案为:H2;Cu;Fe(OH)3;
(2)滤液Y中含有的阳离子除氢离子以外,还含有Fe3+和Al3+,
故答案为:Fe3+;Al3+;
(3)滤液M中含有的阴离子除了硫酸根离子、氢氧根离子外,铝离子与氢氧化钠反应生成的AlO2-离子,
故答案为:AlO2-.
本题解析:
本题难度:简单
4、选择题 用洁净的铂丝蘸取某无色溶液,放在无色火焰上灼烧,透过蓝色钴玻璃,火焰的颜色呈紫色下列说法正确的是( )
A.该溶液中阳离子只有钾离子
B.该溶液中一定含有钠离子
C.该溶液中可能含有钠离子,但一定含有钾离子
D.该溶液中可能含有钾离子,但一定含有钠离子
参考答案:C
本题解析:
本题难度:一般
5、填空题 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO
、SO、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如右图所示:
(1)水样中一定含有的阴离子是______,其物质的量浓度之比为______.
(2)写出BC段所表示反应的离子方程式:______.
(3)由B到C点变化过程中消耗硝酸的体积为______.
(4)试根据实验结果推测K+是否存在?______(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是______.(若K+不存在,则不必回答该问).
(5)设计简单实验验证原水样中可能存在的离子:______.(写出实验步骤、现象和结论)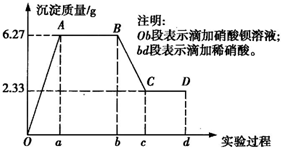
参考答案:该水样为无色溶液,水样Fe3+、Cu2+不存在,依据图象分析加入硝酸钡溶液生成沉淀,加入稀硝酸,沉淀部分溶解证明水样中一定含有SO42-,CO32-,又因为Al3+与CO32-发生双水解,CO32-与Ag+、Ca2+、Mg2+发生反应生成沉淀不能大量存在,所以Al3+、Ag+、Ca2+、Mg2+不存在;n(SO42-)=2.33g233g/mol=0.01mol,n(CO32-)=n(BaCO3)=6.27g-2,33g197g/mol=0.02mol;c(SO42-):c(CO32-)=1:2;原溶液中可能含有Cl-,依据电解质溶液中电荷守恒,阳离子K+一定存在;根据电荷守恒得到:0.01mol×2+0.02mol×2+n(Cl-)=n(K+)推知n(K+)≥0.06mol,则c(K+)≥0.6mol/L;
(1)水样中一定含有的阴离子是SO42-,CO32-;其物质的量浓度之比为1:2;
故答案为:SO42-,CO32-;1:2;
(2)BC段所表示反应是碳酸钡溶于稀硝酸的反应,反应的离子方程式:BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)由B到C点变化过程中依据图象分析软件的碳酸钡n(BaCO3)=6.27g-2,33g197g/mol=0.02mol;消耗稀硝酸物质的量为0.04mol,消耗硝酸的体积=nc=0.04mol1mol/L=0.04L=40ml,故答案为:40ml;
(4)依据电解质溶液中电荷守恒,阳离子K+一定存在;根据电荷守恒得到:0.01mol×2+0.02mol×2+n(Cl-)=n(K+)推知n(K+)≥0.06mol,则c(K+)≥0.6mol/L,故答案为:是;≥0.6mol/L;
(5)可能存在的离子是Cl-,实验设计为:取少量水样与试管中,向试管中加入过量升温硝酸钡溶液和稀硝酸,待沉淀完全和无气体生成后,向上层清液中滴加适量的硝酸银溶液,若生成白色沉淀,则原水样中 含有Cl-,若无白色沉淀生成,证明无Cl-存在,
故答案为:取少量水样与试管中,向试管中加入过量升温硝酸钡溶液和稀硝酸,待沉淀完全和无气体生成后,向上层清液中滴加适量的硝酸银溶液,若生成白色沉淀,则原水样中 含有Cl-,若无白色沉淀生成,证明无Cl-存在.
本题解析:
本题难度:一般