1、选择题 为了使0.1 mol·L-1 Na2CO3溶液中c( )接近0.1 mol·L-1,应采取(? )
)接近0.1 mol·L-1,应采取(? )
A.加水
B.通入CO2
C.加入少量盐酸
D.加入少量固体NaOH
参考答案:D
本题解析:采取的方法是抑制 的水解。
的水解。
本题难度:简单
2、选择题 常温下,有下列四种溶液:
①
| ②
| ③
| ④
|
0.1mol/L
NaOH溶液
| pH=11
NaOH溶液
| 0.1mol/L
CH3COOH溶液
| pH=3
CH3COOH溶液
|
?
下列说法正确的是
A.由水电离出的c(H+):③>①
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH)
D.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COOˉ)>c(H+)>c(Na+)>c(OHˉ)
参考答案:AD
本题解析:NaOH是强碱、CH3COOH是弱酸,它们都能使水的电离平衡(H2O H++OHˉ)左移,且前者使水的电离平衡左移的程度大于后者,导致水电离出的氢离子浓度更小,故A正确;根据稀释定律:c1?V1=c2?V2,则③稀释到原来的100倍后,醋酸的浓度变为0.001mol/L,但是醋酸是弱酸,即使稀释100倍液不能完全电离,则溶液中氢离子浓度小于0.001mol/L,由于pH=-lgc(H+),则溶液pH>3,不可能与④相同,故B错误;若①与③等体积混合,根据n=c?V可知,NaOH和CH3COOH恰好完全中和,得到的CH3COONa是强碱弱酸盐,混合后溶液呈弱碱性,pH>7,若溶液的pH=7,则醋酸一定过量,因此V(NaOH)<V(CH3COOH),故C错误;醋酸溶液存在如下平衡:CH3COOH
H++OHˉ)左移,且前者使水的电离平衡左移的程度大于后者,导致水电离出的氢离子浓度更小,故A正确;根据稀释定律:c1?V1=c2?V2,则③稀释到原来的100倍后,醋酸的浓度变为0.001mol/L,但是醋酸是弱酸,即使稀释100倍液不能完全电离,则溶液中氢离子浓度小于0.001mol/L,由于pH=-lgc(H+),则溶液pH>3,不可能与④相同,故B错误;若①与③等体积混合,根据n=c?V可知,NaOH和CH3COOH恰好完全中和,得到的CH3COONa是强碱弱酸盐,混合后溶液呈弱碱性,pH>7,若溶液的pH=7,则醋酸一定过量,因此V(NaOH)<V(CH3COOH),故C错误;醋酸溶液存在如下平衡:CH3COOH H++CH3COOˉ,如果向醋酸溶液中滴入少量NaOH溶液,消耗氢离子导致上述平衡右移,但是酸碱发生中和反应时,醋酸远远过量,NaOH严重不足,则所得溶液中可能出现:c(CH3COOˉ)>c(H+)>c(Na+)>c(OHˉ),故D正确。
H++CH3COOˉ,如果向醋酸溶液中滴入少量NaOH溶液,消耗氢离子导致上述平衡右移,但是酸碱发生中和反应时,醋酸远远过量,NaOH严重不足,则所得溶液中可能出现:c(CH3COOˉ)>c(H+)>c(Na+)>c(OHˉ),故D正确。
本题难度:简单
3、选择题 根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
化学式
| 电离常数
|
HClO
| K=3×10-8
|
H2CO3
| K1=4.3×10-7
|
K2=5.6×10-11
|
A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
D.c(Na+)=c(HCO3-)+ c(CO32-) + c(H2CO3) +c(ClO-) +c(HClO)
参考答案:A
本题解析:c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-) + 2c(CO32-)
c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+ c(CO32-)
2c(Na+)=c(HCO3-)+ c(CO32-) + c(H2CO3) +c(ClO-) +c(HClO)
本题难度:简单
4、选择题 下列过程或现象与盐类水解无关的是
A.草木灰不能与铵混合使用态氮肥
B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深
D.浓硫化钠溶液有臭味
参考答案:B
本题解析:A、草木灰不能与铵混合使用态氮肥,是因为草木灰(主要成分为碳酸钾)中的碳酸根离子与氮肥中的氨根离子发生双水解,正确;B、铁在潮湿的环境下生锈,是因为形成了原电池,错误;C、加热氯化铁溶液颜色变深,是因为铁离子水解程度增大,生成了氢氧化铁而已,正确;D、浓硫化钠溶液有臭味,是因为硫化钠中的硫离子水解生成硫化氢,加热后水解程度增大,硫化氢气体放出,正确。
本题难度:一般
5、选择题 常温下,向20 mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )。
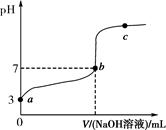
A.a与b之间的溶液中只存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b与c之间的溶液中不存在:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
C.b点时,V(NaOH溶液)=20 mL,且c(CH3COO-)=c(Na+)
D.a、b、c点表示的溶液中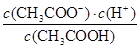 均相等
均相等
参考答案:AC
本题解析:对于选项A,a与b之间的溶液中初始阶段存在c(CH3COO-)>c(H+)>c(Na+)>c(OH-),后期阶段存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-),该选项不正确;对于选项C,b点时,因c(H+)=c(OH-),故有c(CH3COO-)=c(Na+),因此V(NaOH溶液)<20 mL。
本题难度:一般