1、选择题 下列常见金属的冶炼原理中不合理的是
?
| 金属
| 冶炼原理
|
A
| Fe
| Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2
|
B
| Hg
| 2HgO 2Hg+O2↑ 2Hg+O2↑
|
C
| Mg
| 2MgO(熔融)  ?2Mg+O2↑ ?2Mg+O2↑
|
D
| Na
| 2NaCl(熔融)  ?2Na+Cl2↑ ?2Na+Cl2↑
|
?
参考答案:C
本题解析:铁的金属性介于中间,一般用还原剂还原,A正确;Hg是不活泼的金属,一般用加热法,B正确;镁是活泼的金属,一般用电解法冶炼,但电解的是熔融的氯化镁,因为氧化镁的熔点高,C不正确;钠是活泼的金属,一般用电解法冶炼,D正确,答案选C。
点评:金属的冶炼一般是依据金属的活泼性选择相应的方法,常见金属冶炼的方法有:1.热分解法:适用于不活泼的金属,如汞可用氧化汞加热制 得;2.热还原法:用还原剂(氢气,焦炭,一氧化碳,活泼金属等)还原;3.电解法:适用于K、Ca、Na、Mg、Al等活泼金属;4.其他方法:如CuSO4+Fe=Cu+FeSO4。
本题难度:一般
2、选择题 化工生产需要用到各种原料,其中与事实相符合的是
A.用乙醇和浓硫酸制乙烯
B.用电解水获得的氢气来合成氨
C.用晒盐后的卤水制溴单质
D.用氢氧化钠和二氧化碳制碳酸钠
参考答案:C
本题解析:乙烯的主要来源是石油,电解水需要消耗大量的电能,不正确。氢氧化钠制取碳酸钠,不经济。所以正确的答案是C。
本题难度:一般
3、选择题 下列有关无机非金属材料的说法中,不正确的是
[? ]
A、高纯硅可用于制造半导体材料
B、SiO2?制成玻璃纤维,由于导电能力强而被用于制造光缆
C、玻璃、水泥、陶瓷其成分均含有硅酸盐
D、Si3N4是一种新型无机非金属材料,可用于制造发动机
参考答案:B
本题解析:
本题难度:简单
4、选择题 对下列过程中发生反应的叙述正确的是
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.Na+、Mg2+、Al3+得电子能力很弱,故常用电解熔融氧化物的方法来制备其单质
C.从铝土矿中分离出氧化铝的过程中不涉及氧化还原反应
D.从海水中提取溴单质的过程所涉及的反应均为置换反应
参考答案:C
本题解析:A. 海水中的钾元素是钾离子,提取氯化钾固体,通过电解得到钾,发生了氧化还原反应,故A.错误; B.Na、Mg用电解熔融氯化物的方法来制备其单质。D海水提溴是先氧化溴离子为溴单质,再用还原剂(如SO2)还原溴单质为溴离子,再用氧化剂氧化溴离子为溴单质.此过程都是化学变化,但不均为置换反应。C铝土矿溶于NaOH溶液中发生Al2O3+2NaOH═2NaAlO2+H2O,没有元素的化合价变化,则不属于氧化还原反应,偏铝酸钠溶液的酸化发生AlO2-+H++H2O═Al(OH)3↓,没有元素的化合价变化,则不属于氧化还原反应,灼烧氢氧化铝固体发生2Al(OH)3 Al2O3+3H2O,没有元素的化合价变化,也不属于氧化还原反应,C正确。
Al2O3+3H2O,没有元素的化合价变化,也不属于氧化还原反应,C正确。
本题难度:一般
5、填空题 (12分)双氧水、过硫酸钾是工业上常用的氧化剂、消毒剂。工业上以铂为阳极,铅或石墨为阴极,电解NH4HSO4溶液得过硫酸铵【(NH4)2S2O8】溶液,其工艺流程为:

(1)将电解后的溶液送往水解器中在减压条件下水解、蒸馏、浓缩分离,精馏得过氧化氢的水溶液,剩余溶液再循环使用。
①写出电解NH4HSO4溶液的化学方程式???
②写出水解器中(NH4)2S2O8溶液的水解方程式???。
③铂价格昂贵,试分析电槽阳极用铂不用铅的原因???。
④试分析水解器中使用减压水解、蒸馏的原因???。
(2)在电解后的过硫酸铵溶液中加入硫酸氢钾,析出过硫酸钾固体,过硫酸钾具有强氧化性,常被还原为硫酸钾,80℃以上易发生分解。
①将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如右图所示(H+浓度未画出)。图中物质X的化学式为???。
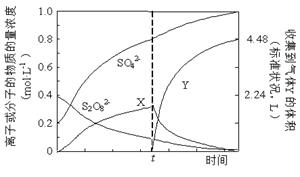
②已知硫酸锰(MnSO4)和过硫酸钾(K2S2O7)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。此反应的离子反应方程式???.
参考答案:(1)①2NH4HSO4 (NH4)2S2O8+H2(2分)
(NH4)2S2O8+H2(2分)
②(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2(2分
③铅会在阳极失电子生成阳离子进入溶液,且在阳极生成的S2O82-会氧化铅(2分)
④减压水解、蒸馏是为了减少双氧水的分解损失。(2分)
(2)①H2O2?(2分)
②2Mn2++5S2O82-+8H2O?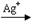 ?2MnO4-+10SO42-+16H+(2分)
?2MnO4-+10SO42-+16H+(2分)
本题解析:(1)电解和水解的反应式均可根据题中所给反应物和生成物书写,可得①2NH4HSO4 (NH4)2S2O8+H2,②(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2。③使用铂的原因是,铅会在阳极失电子生成阳离子进入溶液,且在阳极生成的S2O82-会氧化铅。④减压水解、蒸馏是为了减少双氧水的分解损失。(2)①刚开始,S2O82-发生反应,产生H2O2 ,而H2O2 易分解,滴入少量FeCl3溶液,即是滴入了催化剂,加快了H2O2 的分解,故在t时含量迅速降低。故物质X就是H2O2 。②得到紫红色溶液,即有高锰酸根生成,故反应离子式为2Mn2++5S2O82-+8H2O?
(NH4)2S2O8+H2,②(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2。③使用铂的原因是,铅会在阳极失电子生成阳离子进入溶液,且在阳极生成的S2O82-会氧化铅。④减压水解、蒸馏是为了减少双氧水的分解损失。(2)①刚开始,S2O82-发生反应,产生H2O2 ,而H2O2 易分解,滴入少量FeCl3溶液,即是滴入了催化剂,加快了H2O2 的分解,故在t时含量迅速降低。故物质X就是H2O2 。②得到紫红色溶液,即有高锰酸根生成,故反应离子式为2Mn2++5S2O82-+8H2O? ?2MnO4-+10SO42-+16H+
?2MnO4-+10SO42-+16H+
点评:本题属于常规工艺流程题,需要利用化学反应原理对生产工艺进行分析,其中涉及的化学原理都是常见化学物质的性质,接下来的小题会涉及不同的知识点来解答,要利用到物质的特殊化学性质,学生应当对这部分知识熟练掌握,最后的图像题,还是将图像信息转化为化学的文字信息来理解。
本题难度:困难