1、填空题 ?T?℃时,将3mol气体A和1mol气体B通入体积为2L的密闭容器内(容积不变),发生反应:3A(g)+B(g) xC(g)?,2min时反应达到平衡状态(温度不变),剩余0.8molB。并测得C的浓度为0.4?mol?/?L.请回答下列问题:
xC(g)?,2min时反应达到平衡状态(温度不变),剩余0.8molB。并测得C的浓度为0.4?mol?/?L.请回答下列问题:
(1)从开始反应至平衡状态,生成C的平均反应速率为___,A的转化率为____.
(2)X=__________
(3)若继续向原平衡状态的混合物容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡将_______(填字母,下同),若通入气体A后,化学平衡将______。
a.向正反应方向移动 b.向逆反应方向移动 c.不移动
(4)?T?℃时,向2L密闭容器中充入4molC,反应达到平衡时,B的物质的量为______。
2、填空题 研究碳、氮、硫氧化物的性质对化工生产和环境保护有重要意义。
(1)下列措施中,有利于降低大气中的CO2、SO2、NO2浓度的有________(填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟利昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)为开发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料。写出由CO和H2生产甲醇的化学方程式:_____________________,用该反应合成1 mol液态甲醇吸收热量131.9 kJ。又知2H2(g)+CO(g)+ 3/2O2(g)=CO2(g)+2H2O(g) △H=-594.1 kJ/mol。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式:_____________________。
(3)硫酸工业生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)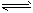 2SO3(g),平衡体系中SO3的百分含量和温度的关系如下图所示。
2SO3(g),平衡体系中SO3的百分含量和温度的关系如下图所示。
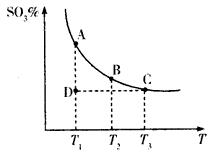
根据图示回答下列问题:
①2SO2(g)+O2(g)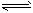 2SO3(g)的△H___0(填“>”或“<”)。
2SO3(g)的△H___0(填“>”或“<”)。
②若温度为T1、T2时,反应的化学平衡常数分别为K1、K2,则K1___K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正_____v逆。
3、选择题 对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
[? ]
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x?mol?NO的同时,消耗x?mol?NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小?,逆反应速率增大
D.化学反应速率的关系是:2v正(NH3)=3v正(H2O)
4、填空题 在一体积为10?L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应: CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
(1)CO和H2O浓度变化如下图,则0~4?min的平均反应速率v(CO)=________mol/(L·min).?

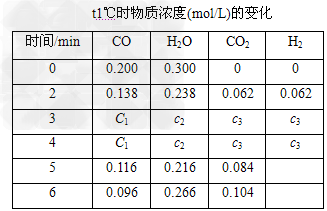
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3?min~4?min?之间反应处于________状态;c1________0.08?mol/L(填“>”“<”或“=”).
②反应在4?min~5?min间,平衡向逆方向移动,可能的原因是________(单选),表中5?min~6?min之间数值发生变化,可能的原因是________(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂? d.增加氢气浓度
5、填空题 向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。下右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3~t4阶段为使用催化剂。
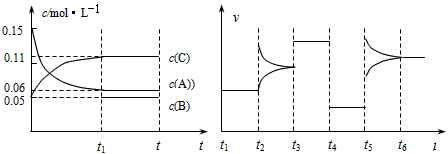
(1)若t1=15s,则t0~t1阶段以C浓度变化表示的反应速率为v(C) =______________。
(2)若t2~t3阶段,C的体积分数变小,此阶段v(正) _________v(逆)(填“>”、“=”、“<”)。
(3)t4~t5阶段改变的条件为_______________,B的起始物质的量为________________。
(4)t5~t6阶段容器内A的物质的量共减小0.03 mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式:___________________