1、填空题 已知常温常压下:① 3Cl2+2NH3→N2+6HCl?,②3Cl2+8NH3→N2+6NH4Cl?
(1)完成并配平反应③的化学方程式,并标出电子转移方向和数目:
③ 3Cl2+4NH3→ ?
(2)在反应③中:还原剂是?,还原产物是?。
(3)若按③反应后产生气体4.48 L(标准状况),则被氧化的气体的物质的量是?mol。
参考答案:
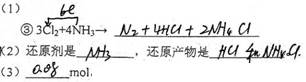
本题解析:略
本题难度:一般
2、选择题 下列工业中,可能不涉及氧化还原反应的是
A.海水淡化工业
B.硫酸工业
C.炼钢工业
D.合成氨工业
参考答案:A
本题解析:A项:海水淡化过程是除去溶液中的离子,基本都是复分解反应,且复分解反应不属于氧化还原反应,故合题意。故选A。
点评:本题以工业生产过程中的原理考查了氧化还原反应,需要学生熟悉各工业的生成流程,才能顺利的解得本题。
本题难度:简单
3、选择题 根据表中信息判断,下列选项不正确的是
序号
| 反应物
| 产物
|
①
| KMnO4、H2O2、H2SO4
| K2SO4、MnSO4…
|
②
| Cl2、FeBr2
| FeCl3、FeBr3
|
③
| MnO4-…
| Cl2、Mn2+…
|
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
参考答案:D
本题解析:第①组发生的化学方程式为2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+8H2O+5O2; 第②组发生的方程式为3Cl2+6FeBr2?=2FeCl3+4FeBr3 ;第③组2Cl-→Cl2,生成1mol氯气时转移2mol电子;D项氧化性Fe3+<Br2,错误。
本题难度:一般
4、选择题 有下列反应:2KMnO4 + 5K2SO3 + 3H2SO4 ══ 6K2SO4 + 2MnSO4 + 3H2O ,在反应中还原产物和氧化产物的物质的量之比为
[? ]
A.1∶4
B.1∶3
C.2∶5
D.3∶2
参考答案:C
本题解析:
试题分析:
在反应:2KMnO4 + 5K2SO3 + 3H2SO4 ══ 6K2SO4 + 2MnSO4 + 3H2O 中,还原产物是指化合价降低得到的产物,是MnSO4 ;氧化产物是指化合价升高得到的产物,是K2SO4 。但6molK2SO4?中只有5mol是氧化产物,所以还原产物与氧化产物的物质的量之比为2:5。
故选:C
本题难度:简单
5、选择题 营养学专家告诫大家:吃饭时不要同时大量食用海鲜(如虾、蟹、牡蛎等,其体内含有无毒的+5价的砷(As)元素)和某些蔬菜水果(如西红柿、土豆等,其体内富含维生素C),否则它们之间容易反应,生成剧毒的As2O3。对于产生剧毒的过程,下列叙述中,不正确的是
[? ]
A.维生素C能将+5价砷氧化成As2O3
B.维生素C具有还原性
C.维生素C在反应中作还原剂
D.含砷物质发生了还原反应
参考答案:A
本题解析:
试题分析:
选项A,维生素C能将+5价砷还原成As2O3;
选项B,维生素C具有还原性,化合价升高;
选项C,维生素C在反应中作还原剂,表现还原性;
选项D,含砷物质化合价降低,发生了还原反应。
故选:A
本题难度:简单