1、选择题 下列各组微粒,按半径由大到小顺序排列的是( )
A.Mg、Ca、K、Na
B.S2-、Cl-、K+、Na+
C.Br-、Br、Cl、S
D.Na+、Al3+、Cl-、F-
参考答案:A.Na和Mg位于第三周期,原子半径Na>Mg,K和Ca位于第四周期,原子半径K>Ca,则原子半径大小顺序为K>Ca>Na>Mg,故A错误;
B.S2-、Cl-、K+核外电子排布相同,都有3个电子层,核电核数越大,半径越小,则有:.S2->Cl->K+,Na+有2个电子层,半径最小,所以半径由大到小的顺序为S2->Cl->K+>Na+,故B正确;
C.Br->Br,同主族元素从上到下原子半径逐渐增大,则Br>Cl,同周期元素从左到右原子半径逐渐减小,则S>Cl,所以半径由大到小的顺序为Br->Br>S>Cl,故C错误;
D.Na+、Al3+、F-核外电子排布相同,都有2个电子层,核电核数越大,半径越小,则有:F->Na+>Al3+,Cl-有3个电子层,离子半径最大,则Cl->F->Na+>Al3+,故D错误.
故选B.
本题解析:
本题难度:一般
2、推断题 已知X?、Y、?Z?、W、?N是短周期中原子序数依次增大的五种主簇元素,通常情况下Y形成的单质为固体,其余的为气体。N是第三周期中阴离子半径最小的元素。Y元素能形成多种不同晶体类型的单质,其中的一种单质在电化学中常用做电极材料。W形成的一种单质具有强氧化性,可做漂白剂和消毒剂。根据上述信息回答下列问题。
(1)X元素是_________,Z元素是___________?。(用元素符号表示)
(2)XYZ形成的晶体为分子晶体,写出其结构式___________;NaYZ的水溶液呈碱性,原因是__________________________?(用离子方程式表示)。
(3)X2W2是一种绿色氧化剂,写出其与酸性淀粉KI溶液反应的离子方程式?________________________________?。
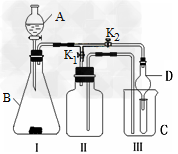
(4)①利用Ⅰ、Ⅱ装置制取气体(K2关闭、K1打开),甲同学认为:利用Ⅱ装置可以收集X2等气体,但不能收集W2?、ZW2或ZW气体,其理由是________________。?
②乙同学认为:利用Ⅱ装置作简单改进(但不改变瓶口朝向),也可以收集W2、ZW等气体,但不能收集ZW2气体,其改进的方法是__________________。
③丙同学想利用上述装置设计实验确认H2SO4、H2CO3和H2SiO3的酸性强弱。(不必再选用其它酸性溶液,且通过一次实验就可以达到目的)实验时,K1关闭、K2打开。锥形瓶内装______固体,装置C(试管)中所盛的试剂是________;出现的现象是____________。
参考答案:(1)H;N
(2)H—C≡N;CN-+H2O HCN+OH-?
HCN+OH-?
(3)2H+?+H2O2?+?2I-=?I2?+?2H2O
(4)①O2、NO2密度比空气大,NO与空气密度相差不大且与空气中的氧气反应;②将Ⅱ装置加满水;③Na2CO3;Na2SiO3溶液;产生白色沉淀
本题解析:
本题难度:一般
3、推断题 (三选一)【物质结构与性质】
原子序数依次递增的A、B、C、D、E是周期表中前30号元素。已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能?层为全充满状态,且核外的未成对电子只有一个。请回答下列问题:
(1)B在周期表中的位置是___________,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)。
(2)根据等电子原理分析,BC2+?中B原子的轨道杂化类型是____________。
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是____________。
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测D元素的电离能突增应出现在第______电离能。
(5)A的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为________;A能形成多种常见单质,在熔点最低的单质中,每个分子周围紧邻的分子数目为___________;?
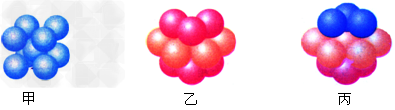
(6)E的基态原子有_____种形状不同的原子轨道;E2+?的价电子排布式为_______;下图_______(填甲、乙或丙)表示的是E晶体中微粒的堆积方式。
参考答案:(1)第二(或2)周期?第ⅤA(或五主、Ⅴ主)族;PH3
(2)sp
(3)原子晶体
(4)五(或I5)
(5)?5:1;?12
(6)3;3d9;丙
本题解析:
本题难度:一般
4、填空题 某元素原子的价电子构型为3d54s1,它属于第四周期,d区元素,最高正化合价为_________,元素符号
是_________。
参考答案:+6;Cr
本题解析:
本题难度:一般
5、选择题 在下面的电子结构中,属于P区的元素是
A.2s2
B.3d34s2
C.3d104s2
D.2s22p3
参考答案:D
本题解析:区的名称来自按构造原理最后填入电子的能级符号。所以现象D正确,A是s区,B是d区,C是ds区,答案选D。
本题难度:困难