1、填空题 (14分)氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)氨气催化氧化的化学方程式为?。
 ?(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)? 2NH3(g);△H=-92.2kJ/mol。
?(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)? 2NH3(g);△H=-92.2kJ/mol。
有关键能:N="N945.6kJ/mol" N-H391.0kJ/mol,则H—H键能为?。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为?。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
物质
| △H(kJ/mol)
|
H2(g)
| -285.8
|
CO(g)
| -283.0
|
CH4(g)
| -890.3
|
?已知1 mol H2O(g)转变为1molH2O(l)时放热44.0kJ。写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式?。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式?。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
?,溶液中离子浓度从大到小的顺序是?。
参考答案:
(1)
(2)436.1kJ/mol
(3)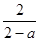
(4)CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)N2+8H++6e-=2NH+4
(6)硫酸铵和硫酸氢铵;c(NH+4)>c(SO2-4)>c(H+)>c(OH-)
本题解析:(1)氨气催化氧化的化学方程式为:4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)945.6+3(H-H)-6×391.0=-92.2? H-H的键能=436.1kJ/mol
(3)N2+ 3H2 2NH3
2NH3
起始? n? 3n? 0
转化 na? 3na? 2na
平衡n(1-a) 3n(1-a)? 2na
起始的物质的量为4n,平衡时的物质的量为n(1-a)+ 3n(1-a)+2na=4n-2na
则容器内气体的压强反应前与平衡时的比值为2/(2-a)
(4)CH4和水蒸气在高温下反应得到CO和H2的热化学方程式:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)正极反应是:N2+8H++6e-=2NH4+
(6)所得溶液中的溶质是硫酸铵和硫酸氢铵,溶液中离子浓度从大到小的顺序是:c(NH+4)>c(SO2-4)>c(H+)>c(OH-)
本题难度:一般
2、填空题 (14分)X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示。
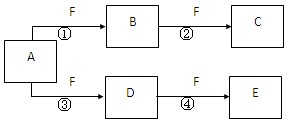
回答下列问题:
(1)Z元素的原子结构示意图为?。
(2)A的电子式为?,组成E的各元素的原子半径由大到小的顺序为?(用元素符号表示)。
(3)写出下列反应的化学方程式:①??③??。
(4)A和E反应生成G,Z2Y是一种麻醉剂,由G在210℃分解生成,该分解反应的化学方程式为?。
(5)常温下,G的水溶液的PH=5,则由水电离的氢离子浓度为?,离子浓度由大到小的关系?。
参考答案:
理科综合试卷·第1页(共16页)
?(1)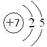 ?(1分)(2)
?(1分)(2)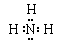 (2分)?N >O> H?(1分)
(2分)?N >O> H?(1分)
(3)①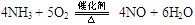 ?
?
③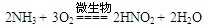 ?(各2分,共4分)
?(各2分,共4分)
(4)? NH4NO3 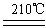 N2O↑ + 2H2O?(2分)
N2O↑ + 2H2O?(2分)
(5)10-5mol/L? c(NO3-)>c(NH4+)>c(H+)>c(OH-) ?(各2分,共4分)
本题解析:A能使湿润红色石蕊试纸变蓝的气体,则A是氨气。D的钠盐是一种致癌物质,则D是亚硝酸,所以X、Y、Z分别是H、O、N。氨气能和氧气反应,所以F是氧气,B是NO,C是NO2,E是硝酸。
(1)氮元素位于第二周期第ⅤA,所以原子结构示意图为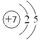 。
。
(2)氨气中含有极性键,电子式为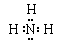 。同周期自左向右原子半径直径减小,同主族自上而下原子半径逐渐增大,所以原子半径大小顺序是N >O> H 。
。同周期自左向右原子半径直径减小,同主族自上而下原子半径逐渐增大,所以原子半径大小顺序是N >O> H 。
微生物
?(3)①是氨气的催化氧化,方程式为4NH3 + 5O2 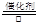 ?4NO + 6H2O。③是氨气被氧化生成亚硝酸,方程式为2NH3 + 3O2 ="===" 2HNO2 + 2H2O 。(4)A和E反应生成G,则G是硝酸铵,Z2Y是N2O,所以分解反应的方程式为 NH4NO3
?4NO + 6H2O。③是氨气被氧化生成亚硝酸,方程式为2NH3 + 3O2 ="===" 2HNO2 + 2H2O 。(4)A和E反应生成G,则G是硝酸铵,Z2Y是N2O,所以分解反应的方程式为 NH4NO3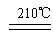 N2O↑ + 2H2O。
N2O↑ + 2H2O。
(5)硝酸铵溶于水水解显酸性,促进水的电离,所以由水电离的氢离子浓度为10-5mol/L。离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-)。
本题难度:一般
3、选择题 关于下列各装置图的叙述中,不正确的是? ( )。
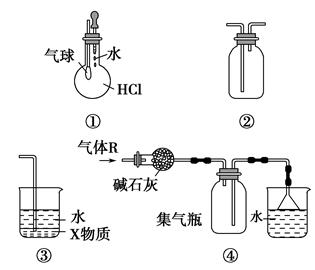
A.装置①可验证HCl气体在水中的溶解性
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2、NO等
C.装置③中X为四氯化碳,可用于吸收氨气或氯化氢
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
参考答案:B
本题解析:装置①中HCl极易溶于水,滴入水后气球膨胀,A选项正确;装置②中,左边导管进气,可收集比空气密度大的气体,如Cl2、HCl、NO2等,右边导管进气,可用于收集比空气密度小的气体,如H2、NH3等,但NO不能用排空气法收集,B选项不正确;四氯化碳的密度比水大,四氯化碳在水的下层,氨气或氯化氢不溶于四氯化碳,可用于吸收氨气或氯化氢,以防止倒吸,C选项正确;氨气的密度比空气小,可用向下排空气法收集,也可用碱石灰干燥,且多余的氨气可通过倒扣的小漏斗用水吸收(NH3极易溶于水),D选项正确。
本题难度:简单
4、选择题 下列反应中,属于氮的固定的是
A.N2和H2在一定条件下生成NH3
B.NO与O2反应生成NO2
C.NH3经催化氧化生成NO
D.由NH3制碳酸氢铵和硫酸铵
参考答案:A
本题解析:解:A、空气在雷电作用下,氮气和氧气反应生成一氧化氮,属于氮的固定,故A正确;
B、NO和O2生成NO2,是氮的化合态之间的转化,不属于氮的固定,故B错误;
C、浓硝酸是含氮化合物,NO2也是含氮化合物,铜与浓硝酸反应是氮的化合态之间的转化,不属于氮的固定,故C错误;
D、NH4Cl与Ca(OH)2反应生成氨气,是氮的化合态之间的转化,不属于氮的固定,故D错误.
故选A.
本题难度:简单
5、填空题 化肥在农业生产中占有重要位置,目前使用的合成氨催化剂是由四氧化三铁主催化剂和助催化剂(万分之一氧化铝和万分之一氧化钾等)组成。N2和H2在催化剂表面反应机理如下(Cata是catalyst缩写,表示催化剂):
①N2(g)+Cata→2N(Cata)
②H2(g)+Cata→2H(Cata)
③N(Cata)+H(Cata)→NH(Cata)
④NH(Cata)+H(Cata)→NH2(Cata)
⑤NH2(Cata)+H(Cata)→NH3(Cata)
⑥…
试探究下列问题:
(1)请补充⑥(最后一步反应)机理的式子:?▲?;
(2)从共价键键能分析,可能最慢的一步是:?▲?(填数字),该过程: ▲?(填放热或吸热)。
(3)石灰氮是一种氮素肥效长的肥料,同时也是一种低毒﹑无残留的农药,它可由电石与氮气反应得到,石灰氮中阳离子与阴离子具有相同的质子总数,试写出制备石灰氮的化学方程式:?▲?。
(4)某研究性学习小组拟用甲醛法测定常见铵态氮肥的含氮量,(资料支撑: 4NH4+ + 6HCHO = (CH2)6N4H+ + 3H+ + 6H2O,所生成的H+和(CH2)6N4H+可用NaOH标准溶液滴定,采用酚酞作指示剂)。用甲醛法测定含氮量,不适合的铵盐是:?▲??(选填序号)。
A.NH4Cl
B.(NH4)2SO4
C.NH4NO3
D.NH4HCO3
参考答案:(1)NH3(Cata)→NH3(g) +(Cata);
(2)①;吸热;
(3)CaC2 + N2→CaCN2 + C,
(4)D
本题解析:催化剂作用原理降低活化能,使得化学键更容易断裂,参加反应最后再释放出来,质量和性质都不变。(1)中容易解出NH3(Cata)→NH3(g) +(Cata);(2)中有一定难度,各种错误都有,主要没有理解,其实没有看清“从共价键键能分析”这个提示性词语,N≡N键能很大;(3)较难,“石灰氮中阳离子与阴离子具有相同的质子总数”要认真解读,阳离子只能是Ca2+,质子数为20,余下只能拼出CN2—。(4)也较难,要读透题中4NH4+ + 6HCHO = (CH2)6N4H+ + 3H+ + 6H2O,有H+产生,容易与HCO3—反应干扰NaOH标准溶液滴定效果。
本题难度:一般