1、计算题 (6分)工业上用NH3、氧气和水作原料,合成化肥硝酸铵100 t。
(1)需要NH3?吨,需要氧气?吨。
(2)若NH3制NO转化率为96%,NO制HNO3转化率为92%,需要NH3?吨(保留两位小数)。
参考答案:(1)42.5? 80?(2)45.31
本题解析:(1)工业生成硝酸铵的反应式为NH3+HNO3=NH4NO3,硝酸铵的物质的量是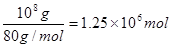 ,所以根据原子守恒可知需要氨气的物质的量是
,所以根据原子守恒可知需要氨气的物质的量是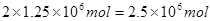 ,其质量是
,其质量是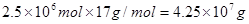 ,即为42.5吨。其中一半的氨气用来生产硝酸,另一半用来生产硝酸铵。生产硝酸的反应为4NH3+5O2
,即为42.5吨。其中一半的氨气用来生产硝酸,另一半用来生产硝酸铵。生产硝酸的反应为4NH3+5O2 4NO+6H2O、4NO+3O2+2H2O=4HNO3。即NH3+O2=HNO3+H2O,所以需要氧气的物质的量是
4NO+6H2O、4NO+3O2+2H2O=4HNO3。即NH3+O2=HNO3+H2O,所以需要氧气的物质的量是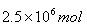 ,其质量是
,其质量是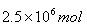 ×32g/mol=80×106g,即质量是80吨。
×32g/mol=80×106g,即质量是80吨。
(2)根据(1)的分析可知生产硝酸的理论上需要氨气是21.25吨,所以根据有关转化率可计算,生产硝酸实际需要氨气是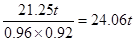 ,所以最终需要的氨气是24.06t+21.25t=45.31t。
,所以最终需要的氨气是24.06t+21.25t=45.31t。
本题难度:一般
2、选择题 氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有氢气生成,下列叙述不正确的是(?)
A.NH4Cl受热能够分解,生成两种气体
B.NH4H溶于水,所得溶液显酸性
C.NH4H固体投入少量水中,有两种气体产生
D.NH4H与水反应时,NH4H是氧化剂
参考答案:BD
本题解析:NH4Cl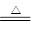 NH3↑+H2O↑、NH4H+H2O= NH3↑+H2O+H2↑
NH3↑+H2O↑、NH4H+H2O= NH3↑+H2O+H2↑
故NH4H投入水中得到氨水呈碱性,反应过程中,NH4H中的—1价氢被氧化为氢气,做还原剂。
本题难度:一般
3、选择题 在下列反应中,最终仍有沉淀的是
[? ]
A、澄清石灰水中通入过量二氧化碳
B、偏铝酸钠溶液中滴加过量盐酸
C、明矾[KAl(SO4)2·12H2O ]溶液中滴加过量氢氧化钡溶液
D、硝酸铝溶液中滴加过量氨水
参考答案:CD
本题解析:
本题难度:一般
4、选择题 某溶液中含有大量Fe2+、Fe3+、Mg2+和NH4+,其C(H+)= 10-2mol/L,在该溶液中可以大量存在的阴离子是(?)
A.SO42-
B.NO3-
C.SCN-
D.CO32-
参考答案:A
本题解析:从已知条件可知,该溶液是在酸性条件下,NO3-在有H+的存在下可表现出HNO3的强氧化性,而Fe2+具有还原性,故NO3-不存在;SCN-与Fe3+可形成络合物也不能共存;CO32-可与H+作用生成HCO3-或H2O和CO2,不能共存,故正确答案只有A。
本题难度:一般
5、选择题 下列结论正确的是( )?
A.酸性:H2SO4>HClO4>H2SO3?
B.酸性:HClO4>H2SO4>H2SO3?
C.氢化物的稳定性:HF>HCl>H2S>H2Te?
D.氢化物的稳定性:HF>H2S>HCl>H2Te?
参考答案:BC
本题解析:S和Cl具有相同的电子层数,非金属性Cl>S,所以酸性HClO4>H2SO4。又因为H2SO4是强酸,H2SO3是中强酸,所以酸性H2SO4>H2SO3,则B项正确。F和Cl同主族,核电荷数F<Cl,非金属性F>Cl,S和Te相比,非金属性S>Te,所以综合起来,非金属性:F>Cl>S>Te,则气态氢化物的稳定性:HF>HCl>H2S>H2Te。C项正确。
本题难度:简单