1、选择题 强酸和强碱稀溶液的中和热可表示为
H+(aq)+OH-(aq) H2O(l);ΔH="-57.3" kJ·mol-1
H2O(l);ΔH="-57.3" kJ·mol-1
已知:
①HCl(aq)+NH3·H2O(aq) NH4Cl(aq)+H2O(l);ΔH="-a" kJ·mol-1
NH4Cl(aq)+H2O(l);ΔH="-a" kJ·mol-1
②HCl(aq)+NaOH(s) NaCl(aq)+H2O(l);ΔH="-b" kJ·mol-1
NaCl(aq)+H2O(l);ΔH="-b" kJ·mol-1
③HNO3(aq)+KOH(aq) KNO3(aq)+H2O(l);ΔH="-c" kJ·mol-1
KNO3(aq)+H2O(l);ΔH="-c" kJ·mol-1
则a、b、c三者的大小关系为(?)
A.a>b>c
B.b>c>a
C.a="b=c"
D.无法比较
参考答案:B
本题解析:考查的是中和热,但因NH3·H2O的电离是吸热的,NaOH(s)溶解是放热的,从而使①中的中和热小于57.3 kJ·mol-1,②中的中和热大于57.3 kJ·mol-1,所以B正确。学生往往只注意到中和热的本质,生成1 mol H2O(l),而忽视其他变化过程中的热效应,而错选C。在教学中应加强从能量、得失电子、离子反应等多角度对化学反应的分析理解,这是教学的忽视点,应引起重视。
本题难度:一般
2、选择题 已知化学反应2C(s)+O2(g)
2CO(g);2CO(g)+O2(g)2CO2(g)都是放热反应.据此推断,下列说法不正确的是(相同条件下)( )
A.56g CO和32g O2所具有的总能量大于88g CO2所具有的总能量
B.12g C所具有的能量一定高于28g CO所具有的能量
C.12g C和32g O2所具有的总能量大于44g CO2所具有的总能量
D.将两份碳燃烧,生成CO2的反应比生成CO的反应放出的热量多
参考答案:A、因2CO+O2═2CO2是放热反应,所以56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量,即反应物的总能量大于生成物的总能量,故A正确;
B、因2C+O2=2CO是放热反应,所以12gC和16gO2所具有的总能量一定高于28gCO所具有的能量,而不是12g C所具有的能量高于28g CO所具有的能量,故B错误;
C、因2C+O2点燃.2CO,2CO+O2点燃.2CO2都是放热反应,所以C+O2点燃.CO2也是放热反应,所以12gC和32O2所具有的总能量一定高于44gCO2所具有的总能量,故C正确;
D、因物质完全燃烧放出的热量比不完全燃烧放出热量多,所以一定质量的碳燃烧,生成CO2比生成CO时放出的热量多,故D正确;
故选B.
本题解析:
本题难度:简单
3、选择题 下列依据相关数据作出的推理和判断中,不正确的是?
A.依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低
B.依据溶解度的数据,选择用重结晶的方法可将粗苯甲酸提纯
C.依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等
D.依据燃烧热的数据、热化学方程式和盖斯定律,可计算一些反应的反应热
参考答案:A
本题解析:A.由于在乙醇分子中含有羟基,使分子之间存在氢键,增加了分子之间的相互作用力,所以不能依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低,错误;B.由于苯甲酸的溶解度受温度的影响变化较大,所以可选择用重结晶的方法可将粗苯甲酸提纯,正确;C.石油是多种物质的混合物,因为不同的物质沸点不同,沸点低的首先气化,沸点高的后气化,所以依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等,正确;D.依据燃烧热的数据、热化学方程式和盖斯定律,不仅可以计算一些能够直接发生反应的反应热,还可以计算不能直接发生反应的反应热,正确。
本题难度:一般
4、填空题 (12分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
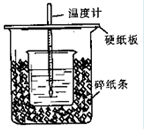
(1)从实验装置上看,图中尚缺少的一种玻璃用品是?。
(2)烧杯间填满碎纸条的作用是?。
(3)大烧杯上如不盖硬纸板,求得的中和热数值?(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量?(填“相等、不相等”),所求中和热?(填“相等、不相等”),简述理由?。
参考答案:(1)环形玻璃搅拌棒?(2)减少实验过程中的热量损失?(3)偏小
(4)不相等;相等;因为中和热是指酸跟碱发生中和反应生成1mol H2O所放出的热量,与酸碱的用量无关
本题解析:考查中和热的测定实验。
(1)在反应中为了使反应进行的更充分,同时也为了使溶液混合均匀,需要搅拌。因此还缺少环形玻璃搅拌棒。
(2)该实验应该离开你减少热量的损失,所以烧杯间填满碎纸条的作用是减少实验过程中的热量损失。
(3)大烧杯上如不盖硬纸板,则会导致热量损失,使测定结果偏小。
(4)如果改变酸碱的物质的量,则反应中放出的热量是不相同的,但中和热是不变的,因为中和热是指酸跟碱发生中和反应生成1mol H2O所放出的热量,与酸碱的用量无关。
本题难度:一般
5、选择题 化学反应的发生必然伴随有能量的转化,其根本原因是( )
A.化学反应中一定有新物质生成
B.化学反应中旧化学键的断裂需要吸收能量,新化学键的生成需要放出能量
C.化学反应通常需要加热等条件才能发生
D.生成物的总能量与反应物的总能量不同
参考答案:化学反应的发生是旧键断裂和新键生成的过程,其中旧键断裂吸收的能量和新键生成释放的能量不同,化学反应必然伴随能量的变化.
A、化学反应的特征是有新物质生成,新物质的生成不是能量变化的原因,故A错误;
B、化学反应的实质:旧键的断裂和新键的生成,旧化学键的断裂需要吸收能量,新化学键的生成需要放出能量,吸收的能量和释放的能量不同,导致化学反应必然伴随能量的变化,故B正确;
C、加热不是所有化学反应的条件,不是化学反应的发生必然伴随有能量的转化的原因,故C错误;
D、生成物的总能量与反应物的总能量不同,会使得化学反应表现为吸热和放热,不是化学反应的发生必然伴随有能量的转化的原因,故D错误.
故选B.
本题解析:
本题难度:简单